Sofosbuvir
Sofosbuvir ist ein medizinischer Wirkstoff, der in Kombination mit anderen Arzneimitteln (Ledipasvir, Daclatasvir, Peginterferon α, Ribavirin) zur Behandlung der chronischen Hepatitis C bei Erwachsenen angezeigt ist. In klinischen Studien konnten bis zu 90 Prozent der betroffenen Patienten geheilt werden.[4][5][6]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
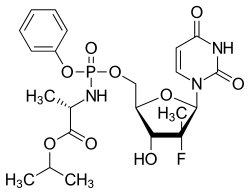 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Sofosbuvir | |||||||||||||||||||||
| Andere Namen |
Isopropyl-(2S)-2-({[(2R,3R,4R,5R)-5-(2,4-dioxopyrimidin-1-yl)-4-fluor-3-hydroxy-4-methyl-tetrahydrofuran-2-yl]methoxy-phenoxy-phosphoryl}amino)propanoat | |||||||||||||||||||||
| Summenformel | C22H29FN3O9P | |||||||||||||||||||||
| Kurzbeschreibung |
weißer kristalliner Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
J05AP08 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Hemmung der NS5B-Polymerase | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 529,453 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Sofosbuvir wird als ein unentbehrliches Arzneimittel in der Liste der Weltgesundheitsorganisation aufgeführt. Das Medikament wurde von Michael J. Sofia bei Pharmasset (jetzt Gilead Sciences) entwickelt, ab 2010 klinisch getestet und 2013/14 in den USA zugelassen.
Wirkungsmechanismus
Sofosbuvir hemmt die RNA-abhängige RNA-Polymerase NS5B. Dieses Enzym spielt eine wichtige Rolle bei der Vermehrung (Replikation) des Hepatitis-C-Virus (HCV). Sofosbuvir ist ein Nukleotid-Prodrug und wird nach intrazellulärer Metabolisierung in die aktive Form (2'R)-2'-Desoxy- 2'-fluor-2'-methyluridin-Triphosphat überführt. Dessen Einbau in die HCV-RNA führt zum Kettenabbruch. Der aktive Metabolit hemmt weder humane DNA- oder RNA-Polymerasen noch die mitochondriale RNA-Polymerase.
Sofosbuvir ist der erste pangenotypisch (das heißt unabhängig vom Genotyp bei allen Genotypen gleichermaßen) wirksame Hemmer der HCV-RNA-Polymerase NS5B. Die US-amerikanische Behörde FDA hatte dem Wirkstoff den Status einer Break Through Therapy zuerkannt.[7]
Jedoch variieren Kombinationstherapie und damit einhergehend die Behandlungsdauer je nach HCV-Genotyp.
Neben- und Wechselwirkungen
Sofosbuvir wurde hauptsächlich in Kombination mit Ribavirin mit und ohne Peginterferon α untersucht. Dabei wurden keine spezifisch durch Sofosbuvir bedingten Nebenwirkungen festgestellt. Die während der Kombinationstherapie am häufigsten auftretenden Nebenwirkungen waren Erschöpfung, Kopfschmerzen, Übelkeit und Schlaflosigkeit. Laborchemisch wurde in sehr wenigen Fällen eine Erhöhung der Creatinkinase sowie der Pankreasenzyme ohne Beschwerden beobachtet. Sofosbuvir besitzt jedoch ein sehr breites Wechselwirkumsspektrum, da es ein Substrat des P-Glykoproteins darstellt. So kann es bei gleichzeitiger Gabe von Johanniskraut, verschiedener Antibiotika, Analeptika und Antikonvulsiva zu einem Abfall der Sofosbuvirkonzentration im Blut kommen. Der Wirkstoff wird über die Nieren ausgeschieden und kann bei Patienten mit eingeschränkter Nierenfunktion deutlich erhöhte Spiegel im Blut zeigen. Im Rahmen einer normalen Hämodialyse wurden rund 18 % des Medikaments aus dem Plasma entfernt, so dass dies auch bei dialysepflichtigen Patienten vorkommen kann.[8]
Handelsnamen
- Sovaldi (EU, USA, CAN)
- Kombination mit Velpatasvir: Epclusa (USA, EU)
- Kombination mit Velpatasvir und Voxilaprevir: Vosevi (USA)
- Kombination mit Ledipasvir: Harvoni (EU, USA)
Kosten
Sovaldi ist in Kanada und den USA seit Dezember 2013, in der EU seit Januar 2014 zugelassen. Der Hersteller Gilead Sciences führte das Medikament 2014 in Deutschland für rund 700 € pro Tablette (20.000 € für eine Dose mit 28 Tabletten).[9] Deutsche Krankenkassen befürchteten daraufhin jährliche Kosten von über einer Milliarde Euro, falls alle der geschätzt 300.000 Hepatitis-C-Infizierten behandelt werden.[10] Eine Therapiedauer von etwa 12 Wochen würde für einen Patienten 60.000 Euro kosten. Im Februar 2015 gab der Hersteller nach Verhandlungen mit den deutschen gesetzlichen Krankenkassen bekannt, der Erstattungsbeitrag pro Packung betrüge 14.500 €. Dies wären laut Spiegel Online 488 € pro Tablette, 43.500 € für eine 12-Wochen-Therapie und 87.000 € für eine 24-Wochen-Therapie mit dem Mono-Präparat. Die Behandlung mit beispielsweise dem Kombinationspräparat Epclusa (Sofosbuvir/Velpatasvir) kostet hingegen für die 12-wöchige Therapie 30.000 €, was einen Preis von 357 € pro Tablette ergäbe. (Stand April 2020)[11][12] Basierend auf einer Kosten-Nutzen-Analyse stand der Preis von Sofosbuvir für drei Viertel der deutschen Patientenpopulation nicht in einem angemessenen Verhältnis zum Nutzen.[13]
In der Schweiz betrug der Preis für eine Tablette 686 Franken im Jahr 2014, für eine 12-wöchige Therapie also 57.624 Franken. Das Schweizer Bundesamt für Gesundheit hatte daher angeordnet, dass die Kosten für das Medikament durch die Grundversicherung nur in den Fällen erstattet wird, in denen Patienten bereits an einer Leberzirrhose leiden (ca. 1.500 Patienten landesweit).[14] Per 1. Oktober 2017 ist diese Vergütungseinschränkung gefallen. Damit können Harvoni und Epclusa allen Hepatitis-C-Patienten verschrieben werden, unabhängig vom Leberschaden. Die Aufhebung der sogenannten Limitatio ging jeweils mit substantiellen Preissenkungen einher, welche auch für die Gilead-Produkte erwartet werden.[15]
Gilead vertreibt Sofosbuvir unter eigener Marke in 101 Ländern mit niedrigem Einkommen mit einem empfohlenen Preis von 900 USD für eine 12-Wochen-Therapie. Das Unternehmen hat zudem Lizenzen zur Herstellung von Sofosbuvir an verschiedene indische Generika-Hersteller für eine 7%ige Lizenzgebühr vergeben. Die Lizenzen erlauben den Export des Wirkstoffs in dieselben 101 Länder.[16]
Weblinks
- Information der Arzneimittelkommission der deutschen Ärzteschaft: Sovaldi
- FDA: Approval of Sovaldi (sofosbuvir) tablets for the treatment of chronic hepatitis C, For Patients and Patient Advocates
Einzelnachweise
- FDA: SOVALDI (sofosbuvir) tablets
- EU: Summary on compassionate use for Sofosbuvir
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Überholter Standard? – Hepatitis C bis zu 90 Prozent auch ohne Interferon heilbar
- Neue Arzneistoffe: Sofosbuvir, Sovaldi (Gilead) pharmazeutische-zeitung.de
- G-BA: Neues Hepatitis-C-Medikament bekommt gute Noten
- FDA approves Sovaldi for chronic hepatitis C. FDA News release, 6. Dezember 2013.
- Christoph Sarrazin, Thomas Berg, Peter Buggisch, Matthias Dollinger, Holger Hinrichsen, Dietrich Hüppe, Michael Manns, Stefan Mauss, Jörg Petersen, Karl-Georg Simon, Heiner Wedemeyer, Stefan Zeuzem: Aktuelle Empfehlung der DGVS und des bng zur Therapie der chronischen Hepatitis C, DGVS-Leitlinien-Addendum veröffentlicht am 5. März 2015, S. 36; zuletzt abgerufen am 8. März 2015 (Memento vom 2. April 2015 im Internet Archive)
- Warum eine Pille 700 Euro kosten darf. Spiegel.de
- kis/DPA: Neues Hepatitis-Medikament sprengt Kassen-Budget. In: stern.de. 6. August 2014, abgerufen am 18. Mai 2019.
- Hepatitis & More: Preisübersicht verfügbare HCV-DAA. In: Hepatitis and More. Hepatitis and More, April 2020, abgerufen am 10. März 2021.
- Nicola Kuhrt: Hepatitis-C-Medikament Sovaldi: Hersteller senkt Pillenpreis. In: Spiegel Online. 12. Februar 2015, abgerufen am 18. Mai 2019.
- Afschin Gandjour: Cost-effectiveness of sofosbuvir in hepatitis C genotype 1 infection in Germany: A reanalysis of published results. In: PLOS ONE. Band 15, Nr. 10, 2. Oktober 2020, ISSN 1932-6203, S. e0236543, doi:10.1371/journal.pone.0236543, PMID 33006987, PMC 7531817 (freier Volltext) – (plos.org [abgerufen am 14. Februar 2021]).
- Rita Flubacher: Eine Packung Pillen für 19.000 Franken. In: Tages-Anzeiger, 7. August 2014, S. 1.
- Hepatitis C: Nun wird auch Harvoni uneingeschränkt vergütet In: medinside.ch, 12. September 2017, abgerufen am 20. November 2017.
- Rapid reductions in prices for generic sofosbuvir and daclatasvir to treat hepatitis C. In: Journal of Virus Eradication. 2, Nr. 1, Januar 2016, S. 28–31. PMID 27482432. PMC 4946692 (freier Volltext).