Tenofovir
Tenofovir ist ein Virostatikum, das als Arzneistoff in der Behandlung von HIV-1-Infektionen und Hepatitis B verwendet wird. Tenofovir gehört zur Gruppe der nukleotidischen Reverse-Transkriptase-Inhibitoren (NtRTI), die klinisch wie die nukleosidischen Reverse-Transkriptase-Inhibitoren (NRTI) eingesetzt werden. Chemisch handelt es sich um ein Nukleotid-Analogon, das aufgrund seiner strukturellen Verwandtschaft mit dem natürlichen Substrat an dessen Stelle in die Virus-DNA eingebaut wird und in der Folge die Vermehrung der Viren hemmt. Die Endung -fovir charakterisiert die Substanz als antiviral wirksames Derivat der Phosphonsäure.[3] Entdecker des Wirkstoffs war Antonín Holý.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
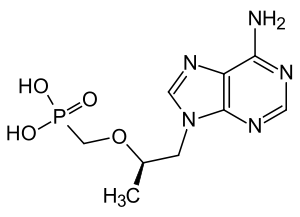 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tenofovir | |||||||||||||||||||||
| Andere Namen |
(R)-[2-(6-Amino-9H-purin-9-yl)-1-methylethoxy]methylphosphonsäure (IUPAC) | |||||||||||||||||||||
| Summenformel | C9H14N5O4P | |||||||||||||||||||||
| Kurzbeschreibung |
Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 287,21 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Tenofovir-Prodrugs
Tenofovir kommt in Form von Prodrugs wie etwa Tenofovirdisoproxil[4] [Bis(isopropoxycarbonyloxy)methoxyester des Tenofovirs] oder Tenofoviralafenamid[5] [(S)-P-[(2S)-1-Oxo-1-(propan-2-yloxy)propan-2-yl]amid und P-Phenylester des Tenofovirs] zur Anwendung. Eine weitere Prodrug-Form ist Tenofovirexalidex.[6]
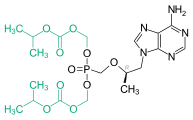 Darstellung des „Resorptionsester“-Prodrug-Konzepts für Tenofovir: Beim Tenofovirdisoproxil ist das modifizierte Adenosin-Nukleotid an der Phosphonatgruppe mit zwei Alkoxycarbonsäuren (Isopropyloxycarbonyloxymethansäure, türkis) verestert.
Darstellung des „Resorptionsester“-Prodrug-Konzepts für Tenofovir: Beim Tenofovirdisoproxil ist das modifizierte Adenosin-Nukleotid an der Phosphonatgruppe mit zwei Alkoxycarbonsäuren (Isopropyloxycarbonyloxymethansäure, türkis) verestert.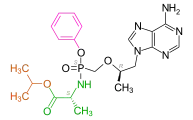 Darstellung des „ProTide“-Prodrug-Konzepts für Tenofovir: Beim Tenofoviralafenamid ist das modifizierte Adenosin-Nukleotid an der Phosphonatgruppe mit einem Arylsubstituenten (Phenylgruppe, rosa) und einem Aminosäureester [(1-Methylethyl)-L-alaninat, orange und grün] maskiert.
Darstellung des „ProTide“-Prodrug-Konzepts für Tenofovir: Beim Tenofoviralafenamid ist das modifizierte Adenosin-Nukleotid an der Phosphonatgruppe mit einem Arylsubstituenten (Phenylgruppe, rosa) und einem Aminosäureester [(1-Methylethyl)-L-alaninat, orange und grün] maskiert.
Pharmazeutisch verwendet werden wasserlösliche Salze beispielsweise der Fumarsäure wie das Tenofovirdisoproxilfumarat[7], Tenofoviralafenamidfumarat[8] oder Tenofoviralafenamidhemifumarat[9].
Anwendung als Arzneimittel
Als Einzelsubstanz
Tenofovir wurde 2001 in den USA und 2002 in der EU in Form des Tenofovirdisoproxilfumarats als Filmtablette zur Behandlung von Infektionen mit dem humanen Immundefizienzvirus (HIV) bei Erwachsenen zugelassen, wobei es stets in Kombination mit anderen antiretroviralen Arzneimitteln anzuwenden ist. 2008 wurde die Indikation erweitert um die Behandlung der chronischen Hepatitis B bei Erwachsenen mit einer kompensierten Lebererkrankung, wenn diese mit bestimmten Befunden, wie etwa erhöhten Alanin-Aminotransferase- Serumwerten, aktiver Leberentzündung bzw. Leberfibrose und nachgewiesener aktiver Virusreplikation einhergeht.
2010 wurde eine Studie bekannt, in der die Wirksamkeit von Tenofovir bei der HIV-Prophylaxe von Frauen untersucht wurde. Die Verabreichung des Wirkstoffs als Vaginalcreme konnte demzufolge das Risiko einer HIV-Infizierung beim Geschlechtsverkehr um 39 % reduzieren.[10] Allerdings wurde in einer späteren Studie der US-amerikanischen National Institutes of Health gezeigt, dass das Präparat als Vaginalcreme wirkungslos ist.[11]
2013 zeigte eine Studie, dass die prophylaktische Anwendung von Tenofovir 49 % (bei regelmäßiger beobachteter Einnahme) bis 74 % (bei entsprechenden Blutspiegeln) der HIV-Infektionen bei Drogensüchtigen verhindern kann. Insgesamt nahmen 2413 Teilnehmer an der Placebo-kontrollierten Studie teil.[12]
Eine weitere Studie zeigte 2013, dass im Tierexperiment mit Tenofovir beschichtete Vaginalringe Infektionen mit HIV-ähnlichen Viren zu 100 % stoppen. Weitere Tests müssen folgen. Das System hätte den Vorteil, die Compliance deutlich zu erhöhen.[13]
Kombination mit Emtricitabin
2012 hat die Food and Drug Administration eine Kombination der Wirkstoffe Tenofovir und Emtricitabin in Tablettenform zur HIV-Prävention zugelassen.[14] Studien der Family Health International (FHI) deuten aber darauf hin, dass auch diese Darreichungsform nur das Infektionsrisiko bei Männern senkt, nicht jedoch bei Frauen.[15]
Am 22. August 2016 hat die Europäische Kommission unter Auflagen die Zulassung für Tenofovir in Kombination mit Emtricitabin unter dem Markennamen Truvada zur Prä-Expositions-Prophylaxe (PrEP) erteilt.[16]
Wirkungsmechanismus
Nach Resorption entsteht aus Tenofovirdisoproxil das mit Adenosinmonophosphat strukturell verwandte Nukleotid-Analogon Tenofovir, das in Virus-befallenen Zellen zum aktiven Tenofovirdiphosphat phosphoryliert wird. Dieses konkurriert in der Nukleinsäuresynthese mit dem natürlichen Substrat Desoxyadenosintriphosphat und inaktiviert für die Reproduktion wichtige virale Enzyme wie die Reverse Transkriptase des HI-Virus bzw. die DNA-Polymerase des Hepatitis-B-Virus („Suizid-Inhibition“). In die DNA eingebaute Nukleotide verhindern außerdem durch ihre chemische Struktur die Anknüpfung weiterer Nukleotide und es kommt zum Kettenabbruch.[17][18]
Tenofoviralafenamid ist im Plasma stabiler als Tenofovirdisoproxil und wird hauptsächlich erst in den Virus-infizierten Zellen über eine Tenofovir-Alanin-Zwischenstufe hydrolysiert zum Tenofovir wie oben beschrieben. Dadurch werden die Selektivität des Wirkstoffes und infolgedessen die intrazellulären Konzentrationen erhöht.[19] Unerwünschten Wirkungen an Nieren und Knochen (Proteinurie, Knochenmineralisierung) treten vermindert auf.
Pharmakokinetik
Die orale Bioverfügbarkeit von Tenofovir beträgt nach nüchterner Einnahme etwa 25 % und erhöht sich mit Nahrungsaufnahmen auf 40 %. Die Plasmaproteinbindung ist gering. Das Potential für Cytochrom P450-vermittelte Wechselwirkungen zwischen Tenofovir und anderen Arzneimitteln wird als gering eingeschätzt.[18] Tenofovir wird größtenteils unverändert renal sowohl durch glomeruläre Filtration als auch durch aktive tubuläre Sekretion ausgeschieden. Die terminale Plasmahalbwertszeit liegt bei 12–18 Stunden.[17][18]
Nebenwirkungen und Anwendungsbeschränkungen
Es liegen keine Daten vor über die Anwendung bei Personen unter 18 Jahren oder bei Patienten über 65 Jahren. Vorsicht ist bei der Therapie niereninsuffizienter Patienten geboten. Aufgrund unzureichender Daten sollte die Nutzen-Risiko-Abwägung in der Schwangerschaft dementsprechend vorgenommen werden. Da nicht bekannt ist, ob Tenofovirdisoproxil in die Muttermilch übertritt, sollten Patientinnen unter der Einnahme von Tenofovirdisoproxil vom Stillen absehen. Es können hauptsächlich gastrointestinale Beschwerden und Kopfschmerzen auftreten, seltener nephrotoxische Nebenwirkungen.[18]
Frühe Nutzenbewertung
In Deutschland müssen seit 2011 neu zugelassene Medikamente mit neuen Wirkstoffen gemäß § 35a SGB V einer „frühen Nutzenbewertung“ durch den Gemeinsamen Bundesausschuss (G-BA) unterzogen werden, wenn der pharmazeutische Hersteller einen höheren Verkaufspreis als nur den Festbetrag erzielen möchte. Nur wenn ein Zusatznutzen besteht, kann der Arzneimittelhersteller mit dem Spitzenverband der gesetzlichen Krankenkassen einen Preis aushandeln. Die Dossierbewertungen, auf deren Basis der G-BA seine Beschlüsse fasst, erstellt das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
Seit 2012 hat Tenofovir in unterschiedlichen Kombinationen sowie als Monopräparat zahlreiche frühe Nutzenbewertungen durchlaufen, überwiegend für die Indikation HIV-Infektion, aber auch für die Behandlung einer chronischen Hepatitis B.[20] Die zweckmäßige Vergleichstherapie hing dabei häufig vom Alter der Betroffenen (Kinder, Jugendliche, Erwachsene) sowie von einer möglichen antiretroviralen Vorbehandlung ab. Gemäß einem G-BA-Beschluss von 2012 gibt es für die Kombination Emtricitabin/Rilpivirin/Tenofovirdisoproxil (Handelsname Eviplera) zur Behandlung antiretroviral nicht vorbehandelter Erwachsener mit einer Viruslast von ≤ 100.000 HIV-1-RNA-Kopien/ml einen Beleg für einen geringen Zusatznutzen gegenüber Efavirenz in Kombination mit zwei Nukleosid-/Nukleotidanaloga (Tenofovir plus Emtricitabin oder Abacavir plus Lamivudin).[21] Für alle anderen Kombinationen, Indikationsgebiete und Vergleiche ist ein Zusatznutzen in den frühen Nutzenbewertungen bis einschließlich 2019 nicht belegt.[22][23][24][25][26][27][28][29][30][31][32][33][34][35][36]
Handelsnamen
- Tenofovirdisoproxil: Viread (D, A, CH), Generika
- Tenofoviralafenamid: Vemlidy (EU, CH)
- Tenofovirdisoproxil + Emtricitabin: Truvada (EU, CH), Generika
- Tenofovirdisoproxil + Emtricitabin + Efavirenz: Atripla (EU, CH), Generika
- Tenofovirdisoproxil + Emtricitabin + Rilpivirin: Eviplera (EU, CH)
- Tenofovirdisoproxil + Emtricitabin + Elvitegravir + Cobicistat: Stribild (EU, CH)
- Tenofovirdisoproxil + Doravirin + Lamivudin: Delstrigo
- Tenofoviralafenamid + Emtricitabin + Elvitegravir + Cobicistat: Genvoya (EU, CH)
- Tenofoviralafenamid + Emtricitabin: Descovy (EU, CH)
- Tenofoviralafenamid + Emtricitabin + Rilpirivin: Odefsey (EU)
- Tenofoviralafenamid + Emtricitabin + Cobicistat + Darunavir: Symtuza
- Tenofoviralafenamid + Bictegravir + Emtricitabin: Biktarvy (EU, CH)
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Tenofovir
Einzelnachweise
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station NJ 2006, ISBN 978-0-911910-00-1
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- The use of stems in the selection of International Nonproprietary Names (INN) for pharmaceutical substances. (PDF; 802 kB) „Stem-Book“ der WHO, 2011.
- Externe Identifikatoren von bzw. Datenbank-Links zu Tenofovirdisoproxil: CAS-Nummer: 201341-05-1, EG-Nummer: 606-442-6, ECHA-InfoCard: 100.114.051, PubChem: 5481350, ChemSpider: 4587262, DrugBank: DB00300, Wikidata: Q27132753.
- Externe Identifikatoren von bzw. Datenbank-Links zu Tenofoviralafenamid: CAS-Nummer: 379270-37-8, PubChem: 9574768, ChemSpider: 7849225, DrugBank: DB09299, Wikidata: Q22075912.
- Externe Identifikatoren von bzw. Datenbank-Links zu Tenofovirexalidex: CAS-Nummer: 911208-73-6, PubChem: 23628250, ChemSpider: 23336649, DrugBank: DB14925, Wikidata: Q27282054.
- Externe Identifikatoren von bzw. Datenbank-Links zu Tenofovirdisoproxilfumarat: CAS-Nummer: 202138-50-9, EG-Nummer: 687-766-5, ECHA-InfoCard: 100.213.968, PubChem: 6398764, ChemSpider: 4911265, DrugBank: DBSALT000172, Wikidata: Q27132754.
- Externe Identifikatoren von bzw. Datenbank-Links zu Tenofoviralafenamidfumarat: CAS-Nummer: 379270-38-9, EG-Nummer: 695-673-6, ECHA-InfoCard: 100.224.335, PubChem: 68516365, ChemSpider: 8005737, Wikidata: Q90688469.
- Externe Identifikatoren von bzw. Datenbank-Links zu Tenofoviralafenamidhemifumarat: CAS-Nummer: 1392275-56-7, EG-Nummer: 805-448-8, ECHA-InfoCard: 100.232.257, PubChem: 71492247, ChemSpider: 29398961, DrugBank: DBSALT002533, Wikidata: Q27162911.
- Q. Abdool Karim, S. S. Abdool Karim u. a.: Effectiveness and safety of tenofovir gel, an antiretroviral microbicide, for the prevention of HIV infection in women. In: Science. Band 329, Nummer 5996, September 2010, S. 1168–1174, doi:10.1126/science.1193748. PMID 20643915. PMC 3001187 (freier Volltext).
- NIH Discontinues Tenofovir Vaginal Gel in 'VOICE' HIV Prevention Study. NIH-News, 25. November 2011.
- K. Choopanya, M. Martin u. a.: Antiretroviral prophylaxis for HIV infection in injecting drug users in Bangkok, Thailand (the Bangkok Tenofovir Study): a randomised, double-blind, placebo-controlled phase 3 trial. In: Lancet. Band 381, Nummer 9883, Juni 2013, S. 2083–2090, doi:10.1016/S0140-6736(13)61127-7. PMID 23769234.
- J. M. Smith, R. Rastogi u. a.: Intravaginal ring eluting tenofovir disoproxil fumarate completely protects macaques from multiple vaginal simian-HIV challenges. In: Proceedings of the National Academy of Sciences. Band 110, Nummer 40, Oktober 2013, S. 16145–16150, doi:10.1073/pnas.1311355110. PMID 24043812. PMC 3791780 (freier Volltext).
- US-Experten empfehlen die Zulassung von Anti-Aids-Pille. Stern, 11. Mai 2012.
- Truvada: HIV-Präventionsstudie gestoppt. (Nicht mehr online verfügbar.) In: Deutsches Ärzteblatt. 19. April 2011, archiviert vom Original am 4. März 2016; abgerufen am 10. Oktober 2019.
- hivandmore.de
- Ernst Mutschler, Gerd Geisslinger, Heyo K. Kroemer, Peter Ruth, Monika Schäfer-Korting: Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 9. Auflage. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2008, ISBN 3-8047-1952-X.
- Zusammenfassung der Merkmale des Arzneimittels Viread. EMA
- P.J. Ruane et al.: Antiviral activity, safety, and pharmacokinetics/pharmacodynamics of tenofovir alafenamide as 10-day monotherapy in HIV-1-positive adults. J Acquir Immune Defic Syndr. 2013 Aug 1;63(4):449-55. doi:10.1097/QAI.0b013e3182965d45.
- Projekte (17). Suche nach Tenofovir auf der IQWiG-Website; abgerufen am 25. März 2020.
- Arzneimittel-Richtlinie/Anlage XII: Emtricitabin, Rilpivirin, Tenofovirdisoproxil. g-ba.de; abgerufen am 25. März 2020
- Nutzenbewertungsverfahren zum Wirkstoff Elvitegravir/Cobicistat/Emtricitabin/Tenofoviralafenamid (HIV-Infektion). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Elvitegravir/Cobicistat/Emtricitabin/Tenofoviralafenamid (HIV-Infektion). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Emtricitabin/Tenofoviralafenamid (HIV-Infektion). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Emtricitabin/Tenofoviralafenamid (HIV-Infektion). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Emtricitabin/Rilpivirin/Tenofoviralafenamid (HIV-Infektion). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Tenofoviralafenamid - 2018 durch neuen Beschluss ersetzt. g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Darunavir/Cobicistat/Emtricitabin/Tenofoviralafenamid (HIV-Infektion). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Elvitegravir/Cobicistat/Emtricitabin/Tenofoviralafenamid (neues Anwendungsgebiet: HIV-Infektion, 6 bis < 12 Jahre). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Bictegravir/Emtricitabin/Tenofoviralafenamid (HIV-Infektion). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Tenofoviralafenamid (Neubewertung nach Fristablauf: Chronische Hepatitis B, ≥ 12 Jahre). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Bictegravir/Emtricitabin/Tenofoviralafenamid (HIV-Infektion). g-ba.de; abgerufen am 25. März 2020.
- Arzneimittel-Richtlinie/Anlage XII: Elvitegravir/Cobicistat/Emtricitabin/Tenofovirdisoproxil. g-ba.de; abgerufen am 25. März 2020.
- Arzneimittel-Richtlinie/Anlage XII: Emtricitabin/ Rilpivirin/ Tenofovirdisoproxil (neues Anwendungsgebiet). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Elvitegravir/Cobicistat/Emtricitabin/Tenofovirdisoproxil (neues Anwendungsgebiet: HIV-Infektion, 12 bis < 18 Jahre). g-ba.de; abgerufen am 25. März 2020.
- Nutzenbewertungsverfahren zum Wirkstoff Doravirin/Lamivudin/Tenofovirdisoproxil (HIV-Infektion). g-ba.de; abgerufen am 25. März 2020.