Ethylenglycolmonoethylether
Ethylenglycolmonoethylether (nach IUPAC-Nomenklatur: 2-Ethoxyethanol, auch als Ethylglycol bekannt) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Glycolether. Es ist ein besonders geschätztes, schwerflüchtiges Lösungsmittel, welches vor allem in der Lackindustrie verwendet wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||||||||
| Name | Ethylenglycolmonoethylether | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H10O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, milde, fast geruchlose ölige Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 90,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,93 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
135 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,4054 (25 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[5] | |||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Gewinnung und Darstellung
Die großtechnische Herstellung von Ethylglycol erfolgt durch Umsetzung von Ethylenoxid mit Ethanol bei Temperaturen von 170–190 °C und Drücken von 10–15 bar. Der Prozess kann entweder homogen mit alkalischen Lösungen wie Natriumhydroxid oder heterogen mit Aluminiumoxid (Al2O3) katalysiert werden.[7]
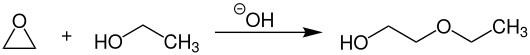
Als Nebenprodukte entstehen immer auch gewisse Mengen an Ethyldiglycol, Ethyltriglycol und weitere, oligomere Ethylglycole. Um deren Bildung jedoch zu vermindern, setzt man für gewöhnlich Ethanol in großem Überschuss ein.[7]
Eigenschaften
Physikalische Eigenschaften
Ethylenglycolmonoethylether hat eine relative Gasdichte von 3,1 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,01 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Die Dichte beträgt 0,93 g/cm3 bei 20 °C. Außerdem weist Ethylglycol einen Dampfdruck von 5,06 hPa bei 20 °C, 9,3 hPa bei 30 °C und 27 hPa bei 50 °C auf. Die Verdunstungszahl (Zeit, in der ein Stoff komplett verdunstet, im Verhältnis zu der Zeit, die Diethylether zum Verdunsten benötigt) beträgt 43.[1] Die elektrische Leitfähigkeit ist mit 4,9·10−7 S·m−1 eher gering.[8]
Chemische Eigenschaften
Ethylglycol ist eine entzündbare, mittel bis schwer flüchtige Flüssigkeit aus der Stoffgruppe der Glycolether. Er ist mit Wasser in jedem Verhältnis und mit allen gebräuchlichen organischen Lösemitteln gut mischbar. Ethylglycol kann mit Luft Peroxide bilden. Außerdem treten heftige Reaktionen mit starken Oxidationsmitteln und Leichtmetallen auf. Eine wässrige Lösung von Ethylglycol reagiert bei 20 °C neutral (pH-Wert bei 7).[1]
Verwendung
2-Ethoxyethanol ist ein ausgezeichnetes Lösungsmittel für Cellulosenitrat, Zelluloid, Ethanol-lösliche Harze, Chlorkautschuk, Polyvinylacetate, Polyvinylbutyrale, Aldehyd- und Ketonharze, Harnstoff- und Melamin-Formaldehyd-Harze, Novolake, Resole, Alkyd- und Maleinat-Harze sowie Polyacrylate. Es löst ebenfalls Rizinus- und Leinöl. Des Weiteren ist es ein häufig verwendetes Lösungsmittel in der Lackindustrie. Aufgrund seiner herausragenden Eigenschaften erhöht es in Lacklösungen die Verschneidfähigkeit und kann wegen seiner langen Verdunstungszeit in zahlreichen Lösungsmittelgemische eingesetzt werden, deren hohe Lösekraft für einen klaren Lackfilm sorgen. Ferner kann Ethylglycol auch Reinigungs- und Abbeizmitteln zugesetzt werden. Auch bei Emulsionen von Pflanzenölen mit Wasser ist Ethylglycol ein geeigneter Lösevermittler, welcher zudem die Stabilität dieser Emulsionen erhöht. Weiterhin wird es auch als Lösungsmittel für natürlichen und synthetischen Kautschuk eingesetzt, da Ethylglycol diesen nicht angreift.[2]
Sicherheitshinweise
Die Dämpfe von Ethylglycol können mit Luft beim Erhitzen über den Flammpunkt explosive Gemische bilden. Hauptsächlich wird 2-Ethoxyethanol über den Atemtrakt und die Haut aufgenommen. Außerdem wird es sehr gut über den Verdauungstrakt resorbiert. Bei der Aufnahme kommt es akut zu leichten bzw. mäßigen Reizwirkungen auf Haut und Schleimhäute. Dabei besteht eine geringe akute inhalative und dermale Toxizität. Bei oraler Vergiftung treten besonders Wirkungen auf das Zentralnervensystem auf. Weiterreichende Folgen sind Stoffwechselstörungen, nervale Funktionsveränderungen, sowie die Beeinflussung von Herz-Kreislauf-, Leber- und Nierenfunktion. Bei längerer Exposition kann es chronisch zu Funktionsstörungen des Blutes und der blutbildenden Organe kommen. Eine Mutagenität sowie eine Kanzerogenität kann ausgeschlossen werden, jedoch wird reproduktionstoxisch von einer fruchtschädigenden Wirkung ausgegangen. Durch Tierversuche wurde zudem eine teratogene Wirkung festgestellt. Ethylglycol weist eine untere Explosionsgrenze (UEG) von 1,8 Vol.-% (67 g/m3) und eine obere Explosionsgrenze (OEG) von 15,7 Vol.-% (590 g/m3) auf. Die Zündtemperatur beträgt 235 °C. Der Stoff fällt somit in die Temperaturklasse T3 und in die Explosionsgruppe IIB. Die Grenzspaltweite wurde mit 0,78 mm bestimmt. Mit einem Flammpunkt von 40 °C gilt Ethylglycol als entflammbar.[1]
Einzelnachweise
- Eintrag zu Ethylenglykolmonoethylether in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. April 2019. (JavaScript erforderlich)
- Eintrag zu Ethylglycol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. April 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-234.
- Eintrag zu 2-Ethoxyethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. April 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 13. April 2019.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 110-80-5 bzw. 2-Ethoxyethanol), abgerufen am 15. September 2019.
- Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 176.
- Technische Regel für Betriebssicherheit – TRBS 2153, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand April 2009, Jedermann-Verlag Heidelberg.


