Eötvössche Regel
Die nach dem ungarischen Physiker Loránd (Roland) Eötvös (1848–1919) benannte Eötvössche Regel erlaubt es, die Oberflächenspannung eines beliebigen flüssigen Reinstoffes bei allen Temperaturen vorherzusagen. Dazu muss lediglich die Dichte, die Molmasse und die kritische Temperatur der Flüssigkeit bekannt sein. Am kritischen Punkt ist die Oberflächenspannung Null.
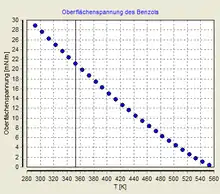
Die erste Aussage der Regel ist:
1. Die Oberflächenspannung hängt linear von der Temperatur ab.
- Diese Regel wird für die meisten bekannten Fälle zumindest ungefähr erfüllt. Bei Auftragung der Oberflächenspannung gegen die Temperatur ergibt sich also zumindest näherungsweise eine Gerade, die bei der kritischen Temperatur eine Oberflächenspannung von Null ergibt.
Die Eötvös-Gleichung beschreibt aber nicht nur die Abhängigkeit der Oberflächenspannung einer Flüssigkeit von der Temperatur, sondern trifft darüber hinaus auch eine weitere wesentliche und umfassendere Aussage:
2. Die Temperaturabhängigkeit der Oberflächenspannung kann für alle Flüssigkeiten so aufgetragen werden, dass sich dabei näherungsweise immer dieselbe Gerade ergibt. Dazu muss entweder die Molmasse und die Dichte der Flüssigkeit oder ihr Molvolumen bekannt sein.
- Die Eötvössche Regel folgt also dem Theorem der übereinstimmenden Zustände, nach dem bei geeigneter Wahl von reduzierten Größen – hier der sogenannten molaren Grenzflächenspannung – alle Stoffe denselben Gleichungen gehorchen.[1]
Mit Hilfe dieser beiden Regeln kann man die Oberflächenspannung einer beliebigen Flüssigkeit bei beliebiger Temperatur vorhersagen.
Eötvös-Gleichung
Ist das molare Volumen und die kritische Temperatur der Flüssigkeit, so ist ihre Oberflächenspannung γ nach der einfachen Eötvös-Gleichung
Die nach Eötvös für alle Flüssigkeiten gültige Eötvös-Konstante hat einen Wert von
mit den Einheiten
- J für Joule
- K für Kelvin
- mol
- erg (im manchmal noch gebräuchlichen cgs-System).
Etwas genauere Werte erhält man, wenn man berücksichtigt, dass die Gerade in der Regel schon 6 K vor dem kritischen Punkt die Temperaturachse schneidet:
Das molare Volumen ist gegeben durch die Molmasse M und die Dichte ρ:
Der Term wird auch als molare Grenzflächenspannung bezeichnet:
Damit lässt sich die Eötvös-Gleichung schreiben als:
Eine sinnvolle Darstellung, die das ungünstige Auftreten der Einheit mol−2/3 vermeidet, wird mit Hilfe der Avogadro-Konstanten NA erhalten:
Wie John Lennard-Jones und Corner 1940 mit der statistischen Mechanik gezeigt haben,[2] ist die Konstante ungefähr gleich der Boltzmannkonstante:
Für das Beispiel Wasser ergibt sich nach Einsetzen aller Größen folgende Zahlenwertgleichung:
- mit den Einheiten
- T in Kelvin
- in
- Dies stimmt mit den experimentell gemessenen Oberflächenspannungen in guter Näherung überein.
Historisches
Eötvös begann schon als Student, sich mit der Oberflächenspannung zu befassen. Er entwickelte eine neue Art und Weise, die Oberflächenspannung zu bestimmen, die Reflexionsmethode. Die Eötvös-Gleichung wurde zunächst rein phänomenologisch gefunden und 1886 veröffentlicht.[3] 1893 zeigten William Ramsay und John Shields (1850–1909) die verbesserte Version, die berücksichtigt, dass die Gerade in der Regel schon vor dem kritischen Punkt die Temperaturachse schneidet. Auch Albert Einstein befasste sich mit der Temperaturabhängigkeit der Oberflächenspannung.[4] John Lennard-Jones und Corner publizierten 1940 eine Herleitung der Gleichung mit der statistischen Mechanik.[2] Masao Katayama (1877–1961) zeigte 1916 eine empirisch gefundene Variante der Eötvös-Gleichung für den Fall, dass die Dichte des Dampfes nicht vernachlässigbar ist im Vergleich zur Dichte der Flüssigkeit.[2] Darauf aufbauend gab E. A. Guggenheim 1945 eine weitere Variante der Gleichung bekannt,[1] die heute Katayama-Guggenheim-Gleichung genannt wird:
Einzelnachweise
- Edward A. Guggenheim: The Principle of Corresponding States. In: The Journal of Chemical Physics. Band 13, Nr. 7, 1945, ISSN 0021-9606, S. 253–261, doi:10.1063/1.1724033.
- John Edward Lennard-Jones und James Corner: The calculation of surface tension from intermolecular forces. In: Transactions of the Faraday Society (1905–1971). Band 36, 1940, S. 1156–1162, doi:10.1039/TF9403601156.
- Roland Eötvös: Ueber den Zusammenhang der Oberflächenspannung der Flüssigkeiten mit ihrem Molecularvolumen. In: G. Wiedemann (Hrsg.): Annalen der Physik. Band 263, Nr. 3. Johann Ambrosius Barth, 1886, S. 448–459, doi:10.1002/andp.18862630309.
- Albert Einstein: Bemerkung zu dem Gesetz von Eötvös. In: Annalen der Physik. Band 339, Nr. 1. Johann Ambrosius Barth, 1911, S. 165–169, doi:10.1002/andp.19113390109.