Nitrobenzaldehyde
Die Nitrobenzaldehyde bilden in der Chemie eine Stoffgruppe, die sich sowohl vom Benzaldehyd als auch vom Nitrobenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Aldehyd- (–CHO) und Nitrogruppe (–NO2). Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C7H5NO3.
| Nitrobenzaldehyde | ||||||
| Name | 2-Nitrobenzaldehyd | 3-Nitrobenzaldehyd | 4-Nitrobenzaldehyd | |||
| Andere Namen | o-Nitrobenzaldehyd | m-Nitrobenzaldehyd | p-Nitrobenzaldehyd | |||
| Strukturformel |  |
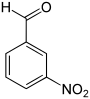 |
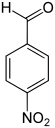 | |||
| CAS-Nummer | 552-89-6 | 99-61-6 | 555-16-8 | |||
| PubChem | 11101 | 7449 | 541 | |||
| Summenformel | C7H5NO3 | |||||
| Molare Masse | 151,12 g·mol−1 | |||||
| Aggregatzustand | fest | |||||
| Kurzbeschreibung | leicht gelbes kristallines Pulver | |||||
| Schmelzpunkt | 41–43 °C[1] | 55 °C[2] | 103–106 °C[3] | |||
| Siedepunkt | 156 °C (20 hPa)[1] | 164 °C (31 hPa)[2] | –[3] | |||
| GHS- Kennzeichnung |
|
|
| |||
| H- und P-Sätze | 302‐315‐319‐335 | 302‐411 | 317‐319‐412 | |||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||
| 261‐305+351+338 | 273 | 261‐280‐302+352 305+351+338 | ||||
Darstellung
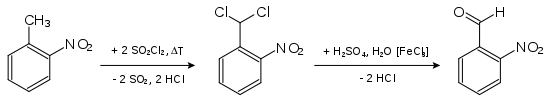
- 2-Nitrotoluol wird in der Hitze chloriert. Das entstandene 2-Nitrobenzylidendichlorid wird verseift, wobei 2-Nitrobenzaldehyd entsteht.
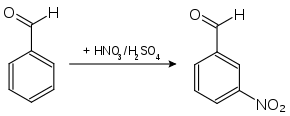
- 3-Nitrobenzaldehyd erhält man aus Benzaldehyd durch Umsetzung mit rauchender Salpetersäure in Gegenwart von konzentrierter Schwefelsäure.[4][5]
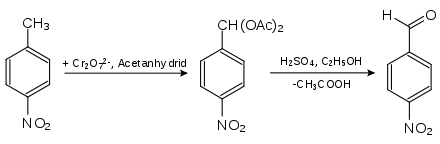
- 4-Nitrobenzaldehyd erhält man aus 4-Nitrotoluol durch Oxidation mit Chrom(VI)-oxid in Acetanhydrid. Das entstehende 4-Nitrobenzaldiacetat wird mit Schwefelsäure in wässrigem Ethanol hydrolysiert.[6]
Eigenschaften
Die Nitrobenzaldehyde sind leicht gelbe kristalline Feststoffe, die zum Teil bittermandelartig riechen. Der 4-Nitrobenzaldehyd, der die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Im basischen Medium disproportionieren in einer Cannizzaro-Reaktion die Nitrobenzaldehyde zu Nitrobenzoesäuren und Nitrobenzylalkoholen.
Siehe auch
Einzelnachweise
- Eintrag zu 2-Nitrobenzaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. März 2016. (JavaScript erforderlich)
- Eintrag zu 3-Nitrobenzaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. März 2016. (JavaScript erforderlich)
- Eintrag zu 4-Nitrobenzaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. März 2016. (JavaScript erforderlich)
- Versuchsvorschrift: Nitrierung von Benzaldehyd zu 3-Nitrobenzaldehyd (PDF) der Sammlung Integriertes Organisch-chemisches Praktikum der Universität Regensburg, abgerufen am 30. Oktober 2011.
- Uni Hamburg: 3-Nitrobenzaldehyd, Versuchsvorschrift (PDF; 24 kB).
- S. V. Lieberman and Ralph Connor: p-Nitrobenzaldehyde In: Organic Syntheses. 18, 1938, S. 61, doi:10.15227/orgsyn.018.0061; Coll. Vol. 2, 1943, S. 441 (PDF).
- Helmut Schmidt: „Indigo – 100 Jahre industrielle Synthese“, in: Chemie in unserer Zeit, 1997, 31 (3), S. 121–128; doi:10.1002/ciuz.19970310304.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.