Natrochalcit
Natrochalcit ist ein sehr selten vorkommendes Mineral aus der Mineralklasse der „Sulfate (und Verwandte, siehe Klassifikation)“. Er kristallisiert im monoklinen Kristallsystem mit der chemischen Zusammensetzung NaCu2(SO4)2(OH)·H2O[1][2] und ist damit chemisch gesehen ein wasserhaltiges Natrium-Kupfer-Sulfat mit einem zusätzlichen Hydroxidion.
| Natrochalcit | |
|---|---|
 | |
| Allgemeines und Klassifikation | |
| Chemische Formel | |
| Mineralklasse (und ggf. Abteilung) |
Sulfate (Selenate, Tellurate, Chromate, Molybdate und Wolframate) |
| System-Nr. nach Strunz und nach Dana |
7.DF.15 (8. Auflage: VI/D.18) 31.08.01.01 |
| Ähnliche Minerale | Kaliochalcit[7] |
| Kristallographische Daten | |
| Kristallsystem | monoklin |
| Kristallklasse; Symbol | monoklin-prismatisch; 2/m |
| Raumgruppe | C2/m (Nr. 12) |
| Gitterparameter | a = 8,809 Å; b = 6,187 Å; c = 7,509 Å β = 118,74°[1] |
| Formeleinheiten | Z = 2[1] |
| Häufige Kristallflächen | {111}, {110}, {221}, {001}[8] |
| Physikalische Eigenschaften | |
| Mohshärte | 4,5 (VHN = 280 kg/mm2) |
| Dichte (g/cm3) | 3,49 (gemessen), 3,54 (berechnet) |
| Spaltbarkeit | sehr vollkommen nach {001} |
| Bruch; Tenazität | uneben; spröde[9] |
| Farbe | hell smaragdgrün; im durchfallenden Licht grün |
| Strichfarbe | blassgrünlich bis grünlichweiß |
| Transparenz | durchscheinend bis durchsichtig |
| Glanz | Glasglanz |
| Kristalloptik | |
| Brechungsindizes | nα = 1,649[8] nβ = 1,655[8] nγ = 1,714[8] |
| Doppelbrechung | δ = 0,065[8] |
| Optischer Charakter | zweiachsig positiv[2] |
| Achsenwinkel | 2V = 36°48′ (gemessen)[2]; 38° (berechnet)[3] |
| Weitere Eigenschaften | |
| Chemisches Verhalten | leicht löslich in Säuren, aber nur sehr langsam löslich in Wasser |
Natrochalcit entwickelt an seiner Typlokalität nach {111} steilpyramidale Kristalle bis zu 1 cm Größe sowie kristalline Krusten und faserige Aggregate. Die Typlokalität des Minerals ist die 15 km von Calama entfernte porphyrische Kupferlagerstätte der „Mina de Chuquicamata“, Provinz El Loa, Region Antofagasta, Chile, die einen der größten Kupfertagebaue der Welt bildet.
Etymologie und Geschichte


Anfang des vorigen Jahrhunderts erhielt das mineralogische Laboratorium der Harvard University von der „Foote Mineral Company“ in Philadelphia Material zur näheren Untersuchung, welches aus der Gegend von Chuquicamata bei Calama, Región de Antofagasta, Chile, stammte. Später, als sich durch die intensive Untersuchung ergab, dass ein Teil der Minerale vermutlich neu war und das wissenschaftliche Interesse an diesem Material deutlich wurde, überließ der Manager der Foote Mineral Co. das gesamte Material generöserweise vollständig der Harvard University. Unter den untersuchten Mineralen befanden sich hell smaragdgrüne Kristalle eines Minerals, welches 1908 von Charles Palache und Charles H. Warren im US-amerikanischen Wissenschaftsmagazin American Journal of Science[8] sowie in einer deutschen Übersetzung im deutschen Wissenschaftsmagazin Zeitschrift für Krystallographie und Mineralogie[10] als Natrochalcit beschrieben wurde. Die Benennung erfolgte nach der chemischen Zusammensetzung aus „Natrium“ und dem altgriechischen Wort χαλκός [chalkos] für „Kupfer“.[8] Das Material war, wie Palache dreißig Jahre später[11] konstatierte, zwar „dürftig“ – trotzdem konnte er an neuem Material die wesentlichen Erkenntnisse der Originalbeschreibung bestätigen. Dieses neue Material stammte aus Funden von O. W. Jarrell und gelangte Mitte der 1930er Jahre an die Harvard University.
Natrochalcit war auch der erste Vertreter der Tsumcoritgruppe, die gelegentlich auch als Natrochalcitgruppe[12][13] beschrieben wird. Das namengebende Mineral Tsumcorit wurde zwar erst 1964 entdeckt und erst 1971 beschrieben, jedoch erwies sich die Struktur der Natrochalcits als identisch mit der des Tsumcorits.
Das Typmaterial für Natrochalcit (zwei Cotypen) wird unter den Katalognummern 97537 und 97538 in der Sammlung des Mineralogical & Geological Museum der Harvard University in Cambridge, Massachusetts, USA, aufbewahrt.[2][14]
Nicht verwechseln darf man Natrochalcit mit „Natrocalcit“. Mit diesen Namen haben Christian Samuel Weiss eine Varietät von Gaylussit[15] und Georg Uttinger, königlich-bairischer Bergamts-Verweser zu Sonthofen, eine Varietät von Datolith[16] bezeichnet.
Klassifikation
Die aktuelle Klassifikation der International Mineralogical Association (IMA) zählt den Natrochalcit zur Tsumcoritgruppe mit der allgemeinen Formel Me(1)Me(2)2(XO4)2(OH,H2O)2,[17] in der Me(1), Me(2) und X unterschiedliche Positionen in der Struktur der Minerale der Tsumcoritgruppe mit Me(1) = Pb2+, Ca2+, Na+, K+ und Bi3+; Me(2) = Fe3+, Mn3+, Cu2+, Zn2+, Co2+, Ni2+, Mg2+ und Al3+ und X = As5+, P5+, V5+ und S6+ repräsentieren. Zur Tsumcoritgruppe gehören neben Natrochalcit noch Cabalzarit, Cobaltlotharmeyerit, Cobalttsumcorit, Ferrilotharmeyerit, Gartrellit, Helmutwinklerit, Kaliochalcit, Krettnichit, Lotharmeyerit, Lukrahnit, Manganlotharmeyerit, Mawbyit, Mounanait, Nickellotharmeyerit, Nickelschneebergit, Nickeltsumcorit, Phosphogartrellit, Rappoldit, Schneebergit, Thometzekit, Tsumcorit, Yancowinnait und Zinkgartrellit.
Bereits in der mittlerweile veralteten, aber noch gebräuchlichen 8. Auflage der Mineralsystematik nach Strunz gehörte der Natrochalcit zur Mineralklasse der „Sulfate (einschließlich Selenate, Tellurate, Chromate, Molybdate und Wolframate)“ und dort zur Abteilung der „Wasserfreie Sulfate, mit fremden Anionen“, wo er zusammen mit Kainit, Uklonskovit und Vonbezingit die Kainit-Natrochalcit-Gruppe mit der System-Nr. VI/D.18 bildete.
Die seit 2001 gültige und von der International Mineralogical Association (IMA) verwendete 9. Auflage der Strunz’schen Mineralsystematik ordnet den Natrochalcit ebenfalls in die Abteilung der „Sulfate (Selenate usw.) mit zusätzlichen Anionen, mit H2O“ ein. Diese ist allerdings weiter unterteilt nach der relativen Größe der beteiligten Kationen, so dass das Mineral entsprechend seiner Zusammensetzung in der Unterabteilung „Mit großen und mittelgroßen Kationen“ zu finden ist, wo es als einziges Mitglied die unbenannte Gruppe mit der System-Nr. 7.DF.15 bildet.
Auch die vorwiegend im englischen Sprachraum gebräuchliche Systematik der Minerale nach Dana ordnet den Natrochalcit in die Klasse der „Sulfate, Chromate und Molybdate“ und dort in die Abteilung der „Wasserhaltigen Sulfate mit Hydroxyl oder Halogen“ ein. Hier ist er das einzige Mitglied der unbenannten Gruppe 31.08.01 innerhalb der Unterabteilung der „Wasserhaltigen Sulfate mit Hydroxyl oder Halogen mit (A+B2+)(XO4)Zq × x(H2O)“.
Chemismus
Vier Mikrosondenanalysen an Natrochalcit ergaben Mittelwerte von 42,23 % CuO; 40,88 % SO3; 9,19 % Na2O; 0,09 % MgO; 0,22 % F; 0,13 % SiO2; 0,07 % ZnO; 0,13 % K2O; 0,02 % Al2O3; 0,02 % MnO; 0,02 % FeO; 0,04 % P2O5 und 0,03 % CaO. Aus ihnen errechnete sich die empirische Formel Na1,00Cu2,02(S0,995O4)2(OH)•H2O, welche zu NaCu2(SO4)2(OH)·H2O idealisiert wurde.[18] Diese Idealformel erfordert Gehalte von 6,99 % Na2O; 42,74 % CuO, 43,01 % SO3 sowie 7,26 % H2O.[2] Zwar wurde bereits 1989 durch Mikrosondenanalysen an Natrochalcitkristallen aus der „Mina Santiagina“, Sierra Gorda, Chile (Smithsonian Institution, R7941), eine Substitution von Natrium durch Kalium im Rahmen von ≈ 2 % bis zu 7 % festgestellt,[1] jedoch wurde erst im Jahre 2014 der Kaliochalcit, das kaliumdominante Analogon zum natriumdominierten Natrochalcit, beschrieben.[7] Da auch das intermediäre Kalium-Natrium-Sulfat (K0,5Na0,5)Cu2(SO4)2[(OH)(H2O)] als synthetische Verbindung bekannt ist[19], besteht zumindest theoretisch die Möglichkeit einen vollständigen Mischkristallreihe zwischen Natrochalcit und Kaliochalcit.
Daneben existieren zahlreiche synthetische Äquivalente wie Me+Cu2(OH)(zO4)•H2O mit Me+ = Na, K, Rb und z = S, Se[20] sowie Ag+Cu2(OH)(SO4)2·H2O und Me+Cu2(OH)(SeO4)2·H2O mit Me+ = Ag, Tl, NH4.[1]
Kristallstruktur
Natrochalcit kristallisiert im monoklinen Kristallsystem in der Raumgruppe C2/m (Raumgruppen-Nr. 12) mit den Gitterparametern a = 8,809 Å; b = 6,187 Å; c = 7,509 Å und β = 118,74° sowie zwei Formeleinheiten pro Elementarzelle.[2]
Die Kristallstruktur des Natrochalcits wird aus Schichten parallel (001) gebildet, die aus Linarit-artigen Ketten bestehen, welche durch gemeinsame Ecken von (SO4)-Tetraedern einer Kette mit CuO4(OH)(H2O)-Oktaedern der benachbarten Kette verbunden sind. Diese Schichten sind durch NaO8-Polyeder und Wasserstoffbrückenbindungen miteinander verknüpft.[6] Giester & Zemann (1987) zufolge sollen die wasserstoffhaltigen Spezies in den Zwischenräumen als (H3O2−) geschrieben werden. Auch nach Anton Beran, Gerald Giester und Eugen Libowitzky bzw. Eugen Libowitzky und Anton Beran enthält Natrochalcit eine H3O2-Gruppe (siehe dazu auch die nebenstehende Zeichnung), die über zwei Sauerstoffatome mit Kupferatomen verbunden ist. Während jedes Sauerstoffatom eines Sulfattetraeders als ein äußerer Protonenakzeptor wirkt, sind die beiden Sauerstoffatome der H3O2−-Gruppe sowohl Donator als auch Akzeptor für die sehr starke zentrale (innere) peudosymmetrische Wasserstoffbindung.[5] Die Ergebnisse FTIR-spektroskopischer Untersuchungen des Wasserstoff-Brückenbindungssystems der H3O2−-Gruppe weisen auf einen nichtzentrosymmetrischen Aufbau dieser H3O2−-Gruppe hin und bestätigen das Auftreten einer sehr starken Wasserstoffbrücke mit einer aufgespaltenen Position des Wasserstoffatoms.[19]
 Struktur von Natrochalcit, projiziert auf (010)
Struktur von Natrochalcit, projiziert auf (010) Struktur der Vertreter der Tsumcorit-Gruppe am Beispiel von Natrochalcit
Struktur der Vertreter der Tsumcorit-Gruppe am Beispiel von Natrochalcit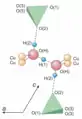 Wasserstoffbrücken-bindungen im Natrochalcit
Wasserstoffbrücken-bindungen im Natrochalcit
Natrochalcit ist isotyp (isostrukturell) zu den monoklinen Vertretern der Tsumcoritgruppe wie Tsumcorit und Lotharmeyerit sowie zu den oben erwähnten synthetischen Äquivalenten.
Eigenschaften
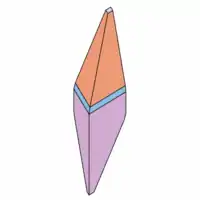
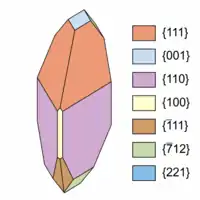
Morphologie
Natrochalcit entwickelt an der Typlokalität nach {111} steilpyramidale Kristalle von maximal 1 cm Größe, an denen die trachtbestimmenden Prismen {111}, {110} und {221} sowie das Basispinakoid {001} identifiziert worden sind (siehe dazu die nebenstehenden Kristallzeichnungen). Die Kristalle sind meist so auf dem Muttergestein aufgewachsen, dass Teile der Prismen zur Ausbildung kommen und eine oszillierende Streifung parallel den Kanten zwischen {111} und {221} auftritt. Die Kristalle des Natrochalcits finden sich entweder isoliert – und dann auch als Doppelender – oder in fest anhaftenden Krusten auf dem weißen Ganggestein.[8]
Weitere beobachtete Flächenformen sind das Pinakoid {010} und die Prismen {112}, {331}, {111} und {211}.[8] An später gefundenen Kristallen wurden ferner das Pinakoid {100} sowie die Prismen {211} und {712} nachgewiesen.[11] Während die Flächenformen {111} und {110} gewöhnlich gut ausgebildet sind, sind die Flächen der anderen Formen meist nur klein und oft auch nicht in ihrer vollständigen Anzahl vorhanden.[8]
Neben den erwähnten krustenförmigen Aggregaten findet sich Natrochalcit ferner in faserigen Aggregaten, die – ähnlich wie Fasergips oder faseriger Coelestin – in bis zu 2 cm mächtigen Gängchen senkrecht zu den Salbändern entwickelt sind.[11][2]
Physikalische und chemische Eigenschaften
Die Kristalle des Natrochalchits sind hell smaragdgrün,[8] ihre Strichfarbe ist dagegen blassgrünlich[2] bis grünlichweiß[3]. Die Oberflächen der durchscheinenden bis durchsichtigen Kristalle weisen einen glasartigen Glanz[8] auf, was gut mit den Werten für die Lichtbrechung (nα = 1,649, nγ = 1,714)[8] übereinstimmt. Unter dem Mikroskop zeigt das Mineral im durchfallenden Licht grüne Farbtöne ohne jeden Pleochroismus.[2]
Natrochalcit besitzt eine sehr vollkommene Spaltbarkeit nach (001).[8] Aufgrund seiner Sprödigkeit bricht er aber ähnlich wie Amblygonit, wobei die Bruchflächen uneben ausgebildet sind.[9] Mit einer Mohshärte von 4,5 gehört das Mineral zu den mittelharten Mineralen, steht damit zwischen den Referenzmineralen Fluorit (Härte 4) und Apatit (Härte 5) und lässt sich wie diese mehr (Fluorit) oder weniger (Apatit) leicht mit dem Taschenmesser ritzen.[8] Die gemessene Dichte für Natrochalchit beträgt 3,49 g/cm³,[11] die berechnete Dichte 3,54 g/cm³.[2]
Vor dem Lötrohr verknistert das Mineral und schmilzt sehr leicht zu einer schwarzen Perle. Im geschlossenen Röhrchen gibt Natrochalcit saures Wasser ab und schmilzt zu einem dunklen Email. Es ist leicht löslich in Säuren, aber nur sehr langsam löslich in H2O.[8]
Bildung und Fundorte


Natrochalcit ist ein typisches Sekundärmineral, welches sich in ariden Klimaten in der Oxidationszone von Kupfer-Lagerstätten bildet. An der Typlokalität Chuquicamata fand sich der Natrochalcit zuerst in einem abgebauten und aufgelassenen Erzgang auf Quarz-Serizit-Matrix oder vollständig eingebettet in Chalkanthit.[8] Später, als der riesige Tagebau von Chuquicamata entstand, wurde das Mineral neben schönen Stufen auch in faserigen Gangausfüllungen gefunden.[11]
Parageneseminerale aus dem Originalfund in Chuquicamata sind Brochantit, Atacamit und Chalkanthit, jedoch kein Kröhnkit.[8] Im zweiten beschriebenen Fund war Natrochalcit verwachsen mit Antlerit, Gips und Kröhnkit[11] sowie Blödit.[2] Als weitere Begleitminerale werden Leightonit, Paratacamit und gediegen Kupfer angegeben.[3]
Als sehr seltene Mineralbildung konnte Natrochalcit bisher (Stand 2018) nur von sieben Fundstellen beschrieben werden.[21][22] Als Typlokalität gilt die klassische Porphyrische Kupferlagerstätte (englisch Porphyry Copper Deposit) der „Mina de Chuquicamata“ bei Calama, Provinz El Loa, Región de Antofagasta, Chile. Weitere, sich ebenfalls in Chile befindende Fundstellen sind das östlich von Baquedano liegende Kupferbergwerk der „Mina Fortuna“ sowie die 93 km ostnordöstlich von Antofagasta liegende, seit 1998 in Förderung stehende porphyrische Kupferlagerstätte „Mina Lomas Bayas“, beide in der Provinz de Antofagasta, Región de Antofagasta.[22] Mit der „Mina Santiagina“ in der Sierra Gorda[1] existiert noch ein weiterer Fundort in Chile, der von den einschlägigen Fundortzusammenstellungen[22] aber nicht genannt wird. Möglicherweise handelt es sich um die „Mina Bella Santiaguina“ – ein altes, im Sierra Gorda District und ebenfalls in der Provinz de Antofagasta liegendes Kupferbergwerk.
Natrochalcit fand sich ferner in verschiedenen Fumarolen am Zweiten Aschenkegel am nördlicher Durchbruch der Großen Spalteneruption (Great Fissure), Vulkan Tolbatschik (Koordinaten des Vulkans Tolbatschik), Region Kamtschatka, Föderationskreis Ferner Osten, Russland.[7]
In den Vereinigten Staaten wurde das Mineral im Ag-Pb-Cu-Zn-Mo-Fluorit-Bergwerk der „Empire Mine“ bei Tombstone im Tombstone District, Tombstone Hills, Cochise County in Arizona, sowie im ehemaligen U-Cu-Bergwerk der „Blue Lizard Mine“, Red Canyon, White Canyon District, San Juan Co., Utah, geborgen.[22]
Einziger europäischer Fundort für Natrochalcit ist die „Cantiere Vallone“ der „Miniera di Capo Calamita“ bei Capoliveri, Insel Elba, Provinz Livorno, Region Toskana in Italien. Vorkommen von Natrochalcit in Deutschland, in Österreich oder in der Schweiz sind damit nicht bekannt.[22]
Verwendung
Aufgrund seiner Seltenheit ist Natrochalcit nur für den Mineralsammler von Interesse. Die anionische Schichtstruktur [Cu2(OH)(H2O)(SO4)2]− mit Ladungsausgleich durch Na+, bei der es sich um ein synthetisches Äquivalent von Natrochalcit handelt, wird aber als Anodenmaterial für sowohl Lithium-Ionen-Akkumulatoren als auch Natrium-Ionen-Akkumulatoren diskutiert.[23]
Siehe auch
Literatur
- Charles Palache, Charles H. Warren: Kroehnkite, natrochalcite (a new mineral), and other sulphates from Chile. In: American Journal of Science. Band 26, 1908, S. 342–348, doi:10.2475/ajs.s4-26.154.342.
- Charles Palache: Kroehnkite and natrochalcite from Chile. In: American Journal of Science. Band 237, 1939, S. 447–455, doi:10.2475/ajs.237.7.447.
- Natrochalcite. In: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Hrsg.): Handbook of Mineralogy, Mineralogical Society of America. 2001 (handbookofmineralogy.org [PDF; 67 kB; abgerufen am 24. Januar 2018]).
- Hans Jürgen Rösler: Lehrbuch der Mineralogie. 4. durchgesehene und erweiterte Auflage. Deutscher Verlag für Grundstoffindustrie (VEB), Leipzig 1987, ISBN 3-342-00288-3, S. 680.
- Friedrich Klockmann: Klockmanns Lehrbuch der Mineralogie. Hrsg.: Paul Ramdohr, Hugo Strunz. 16. Auflage. Enke, Stuttgart 1978, ISBN 3-432-82986-8, S. 616 (Erstausgabe: 1891).
Weblinks
- Mineralienatlas:Natrochalcit (Wiki)
- Mindat – Natrochalcit (englisch)
- Webmineral – Natrochalcit (englisch)
- RRUFF Database-of-Raman-spectroscopy - Natrochalcit (englisch)
- American-Mineralogist-Crystal-Structure-Database – Natrochalcit (englisch)
Einzelnachweise
- Gerald Giester: The crystal structures of Ag+Cu2(OH)(SO4)2·H2O and Me+Cu2(OH)(SeO4)2·H2O [Me+ = Ag, Tl, NH4], four new representatives of the natrochalcite type, with a note on natural natrochalcite. In: Zeitschrift für Kristallographie. Band 187, Nr. 3-4, 1989, S. 239–247, doi:10.1524/zkri.1989.187.3-4.239.
- Natrochalcite. In: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Hrsg.): Handbook of Mineralogy, Mineralogical Society of America. 2001 (handbookofmineralogy.org [PDF; 67 kB; abgerufen am 24. Januar 2018]).
- Mindat – Natrochalcit
- Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. 9. Auflage. E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 407.
- Eugen Libowitzky, Anton Beran: IR Spectroscopic characterization of hydrous species in minerals. In: Notes in Mineralogy Vol. 6 Spectroscopic Methods in Mineralogy (Anton Beran, Eugen Libowitzky, Ed.). 1. Auflage. Eötvös University Press, Budapest 2004, ISBN 963-463-662-4, S. 247–250.
- Frank C. Hawthorne, Sergey V. Krivovichev, Peter C. Burns: The Crystal Chemistry of Sulfate Minerals. In: Charles N. Alpers, John L. Jambor, D. Kirk Nordstrom (Hrsg.): Sulfate Minerals: Crystallography, Geochemistry, and Environmental Significance (= Reviews in Mineralogy and Geochemistry. Band 40). 2000, ISBN 978-0-939950-52-2, S. 1–112, doi:10.2138/rmg.2000.40.1 (minsocam.org).
- Igor V. Pekov, Oleg I. Siidra, Nikita V. Chukanov, Vasiliy O. Yapaskurt, Dmitriy I. Belakovskiy, Mikhail N. Murashko, Evgeny G. Sidorov: Kaliochalcite, KCu2(SO4)2[(OH)(H2O)], a new tsumcorite-group mineral from the Tolbachik volcano, Kamchatka, Russia. In: European Journal of Mineralogy. Band 26, Nr. 4, 2014, S. 597–604, doi:10.1127/0935-1221/2014/0026-2394 (researchgate.net [PDF; 406 kB; abgerufen am 24. Januar 2018]).
- Charles Palache, Charles H. Warren: Kroehnkite, natrochalcite (a new mineral), and other sulphates from Chile. In: American Journal of Science. Band 26, 1908, S. 342–348, doi:10.2475/ajs.s4-26.154.342.
- Webmineral – Natrochalcit
- Charles Palache, Charles H. Warren: Kröhnkit, Natrochalcit (ein neues Mineral) und andere Sulfate aus Chile. In: Zeitschrift für Krystallographie und Mineralogie. Band 45, Nr. 6, 1908, S. 529–538, doi:10.1524/zkri.1908.45.1.529.
- Charles Palache: Kroehnkite and natrochalcite from Chile. In: American Journal of Science. Band 237, 1939, S. 447–455, doi:10.2475/ajs.237.7.447.
- Robert Krickl, Manfred Wildner: Crystal chemistry of synthetic Co- and Ni-analogues of natrochalcite – the shortest known hydrogen bonds among mineral-type compounds Part I: Single-crystal X-ray structures. In: European Journal of Mineralogie. Band 19, 2007, S. 805–816, doi:10.1127/0935-1221/2007/0019-1770.
- Yongbo W. Yang, Stanley H. Evans, Robert T. Downs, Hexiong Yang: Lotharmeyerite, Ca(Zn,Mn)2(AsO4)2(H2O,OH)2. In: Acta Crystallographica Section E Structure Reports. E68, 2012, S. i9–i10, doi:10.1107/S1600536811054286.
- Catalogue of Type Mineral Specimens – N. (PDF 61 kB) In: docs.wixstatic.com. Commission on Museums (IMA), 12. Dezember 2018, abgerufen am 29. August 2019.
- Ernst Friedrich Glocker: Grundriß der Mineralogie, mit Einschluß der Geognosie und Petrefactenkunde. Für höhere Lehranstalten und zum Privatgebrauch. 1. Auflage. Johann Leonhard Schrag, Nürnberg 1839, S. 377–384 (online verfügbar in Grundriß der Mineralogie, mit Einschluß der Geognosie und Petrefactenkunde, S. 673 ff. in der Google-Buchsuche).
- Georg Uttinger: Aus einem Schreiben des Hrn. Bergverwesers Uttinger in Sonthofen vom 15. Sept. 1809. In: Neue Jahrbücher der Berg- und Hüttenkunde. Band II. Steinische Buchhandlung, Nürnberg 1812, S. 278–3290 (online verfügbar in Neue Jahrbücher der Berg- und Hüttenkunde, S. 289 ff. in der Google-Buchsuche).
- Werner Krause, Klaus Belendorff, Heinz-Jürgen Bernhardt, Catherine McCammon, Herta Effenberger, Werner Mikenda: Crystal chemistry of the tsumcorite-group minerals. New data on ferrilotharmeyerite, tsumcorite, thometzekite, mounanaite, helmutwinklerite, and a redefinition of gartrellite. In: European Journal of Mineralogy. Band 10, Nr. 2, 1998, S. 179–206, doi:10.1127/ejm/10/2/0179.
- RRUFF – Natrochalcit
- Anton Beran, Gerald Giester, Eugen Libowitzky: The hydrogen bond system in natrochalcite-type compounds - an FTIR spectroscopic study of the H3O− unit. In: Mineralogy and Petrology. Band 61, Nr. 1–4, 1997, S. 223–235, doi:10.1007/BF01172486.
- Gerald Giester, Josef Zemann: The crystal structure of the natrochalcite-type compounds Me+Cu2(OH)(zO4)2·H2O [Me+ = Na, K, Rb; z = S, Se], with special reference to the hydrogen bonds. In: Zeitschrift für Kristallographie. Band 179, Nr. 1-4, 1989, S. 431–442, doi:10.1524/zkri.1987.179.14.431 (rruff.info [PDF; 484 kB; abgerufen am 24. Januar 2018]).
- Mindat – Anzahl der Fundorte für Natrochalcit
- Fundortliste für Natrochalcit beim Mineralienatlas und bei Mindat
- Zhen Liu, Huajun Zhou, Simon S. Ang, Jian-Jun Zhang: Evaluation of Low-cost Natrochalcite Na[Cu2(OH)(H2O)(SO4)2] as an Anode Material for Li- and Na-ion Batteries. In: Electrochimica Acta. Band 211, 2016, S. 619–626, doi:10.1016/j.electacta.2016.05.129.