N,N,N′,N′-Tetramethylformamidiniumchlorid
N,N,N′,N′-Tetramethylformamidiniumchlorid ist der einfachste Vertreter von quartären Formamidiniumkationen der allgemeinen Formel [R2N-CH=NR2]+ mit Chlorid als Gegenion, in dem alle Wasserstoffatome des protonierten Amidins Formamidin [HC(=NH2)NH2]+ durch Methylgruppen ersetzt sind.[4]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
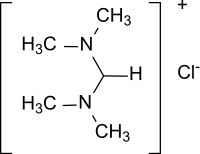 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | N,N,N′,N′-Tetramethylformamidiniumchlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H13ClN2 | |||||||||||||||
| Kurzbeschreibung |
Hellgelber kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 136,62 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser, in Acetonitril[2] und N,N-Dimethylformamid[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
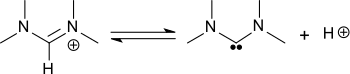
Durch Deprotonierung entsteht das außerordentlich basische Carben Bis(dimethylamino)carben der Formel R2N-C:-NR2.[5]
Vorkommen und Darstellung
N,N,N′,N′-Tetramethylformamidiniumchlorid entsteht bei der Reaktion von Dimethylformamid (DMF) mit Dimethylcarbamoylchlorid in sehr hoher Ausbeute (95 %),[3]
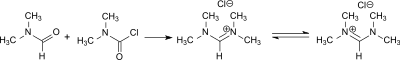
Eine mit 72 % wesentlich geringere, aber angesichts der diffizilen Handhabung des Chloridsalzes realistischere Ausbeute liefert die Umsetzung von DMF mit Thionylchlorid im Verhältnis 3:1.[2]
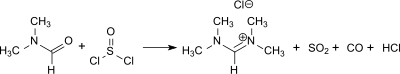
Eigenschaften
N,N,N′,N′-Tetramethylformamidiniumchlorid ist ein hellgelber, stark hygroskopischer Feststoff.[6]
Zur Trocknung wird das Salz in Dichlormethan gelöst und die Lösung mit festem wasserfreiem Natriumsulfat versetzt. Nach mehrmaligem Auflösen in Dichlormethan/Aceton und Fällen mit Tetrahydrofuran wird ein farbloser Feststoff erhalten, der unter Luft- und Feuchtigkeitsabschluss beständig ist.[4]
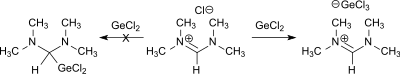
Die Vermutung eines mesomeren Gleichgewichts zwischen ionischer Formamidiniumchlorid- und kovalenter Bis(dimethylamino)chlormethan-Struktur
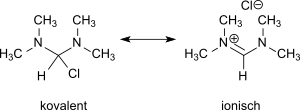
konnte durch Umsetzung mit Germanium(II)-chlorid bzw. Zinn(II)-chlorid zugunsten des Vorliegens von N,N,N′,N′-Tetramethylformamidiniumchlorid entschieden werden.[7]
Die extreme Hygroskopie des Chloridsalzes erschweren die Handhabung der Verbindung erheblich. Daher wurden auch Synthesen der wesentlich besser handhabbaren Salze N,N,N′,N′-Tetramethylformamidinium-methylsulfat[6] aus dem Dimethylformamid-Dimethylsulfat-Komplex[8] und von N,N,N′,N′-Tetramethylformamidinium-p-toluolsulfonat aus DMF und p-Toluolsulfonsäurechlorid beschrieben.[9][10]
Anwendungen
N,N,N′,N′-Tetramethylformamidiniumchlorid eignet sich als Reagens zur Aminomethylenierung, d. h. zur Einführung einer =CH-NR1R2-Funktion an CH-acide Verbindungen. So reagiert Cyanessigsäureethylester mit dem Formamidiniumsalz in Gegenwart von festem Natriumhydroxid praktisch quantitativ zum Ethyl(dimethylaminomethylen)cyanacetat.[11]
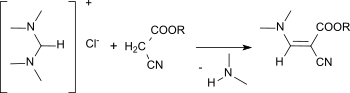
Die Aminomethylenierung liefert Zwischenprodukte für die Synthese von Heterocyclen, wie z. B. Indole, Pyrimidine, Pyridine und Chinolone.
Aus N,N,N′,N′-Tetramethylformamidiniumchlorid entsteht mit Alkalimetall-dimethylamiden, wie z. B. Lithiumdimethylamid oder Natriumdimethylamid Tris(dimethylamino)methan in Ausbeuten von 55–84 %.[12][13][14]
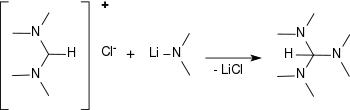
Das Reaktionsprodukt eignet sich ebenfalls als Reagens zur Formylierung und Aminomethylenierung.
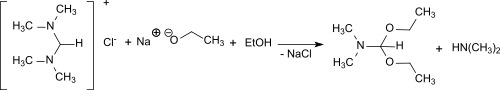
Aus N,N,N′,N′Tetramethylformamidiniumchlorid und Natriumethylat in Ethanol bildet sich in 68%iger Ausbeute Dimethylformamid-diethylacetal.[15]
Mit wässrigem Natriumcyanid reagiert das N,N,N′,N′-Tetramethylformamidinium-salz zu Bis(dimethylamino)acetonitril>[16]
acetonitril.svg.png.webp)
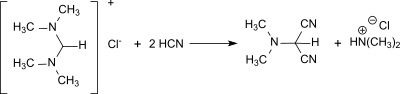
Mit wasserfreier Blausäure entsteht aus N,N,N′,N′-Tetramethylformamidiniumchlorid in 92%iger Ausbeute Dimethylaminomalonsäuredinitril[17]
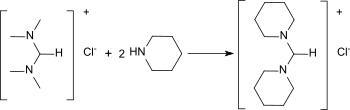
N,N,N′,N′-Tetramethylformamidiniumchlorid kann mit cycloaliphatischen Aminen zu den entsprechenden heterocyclischen Formamidinen umgaminiert werden.[17]
In jüngerer Zeit wurde auch der Einsatz von N,N,N′,N′-Tetramethylformamidiniumchlorid als Katalysator bei der Darstellung von Carbonsäurechloriden aus Carbonsäuren und Phosgen berichtet.[18]
Starke Basen, wie z. B. Phenyllithium können aus dem Formamidinium-kation von N,N,N′,N′-Tetramethylformamidiniumchlorid ein Proton unter Bildung von Bis(dimethylamino)carben abstrahieren.[4][5]
Einzelnachweise
- Datenblatt N,N,N′,N′-Tetramethylformamidinium-chlorid bei Sigma-Aldrich, abgerufen am 20. Oktober 2016 (PDF).
- W. Kantlehner, P. Speh: Säureamid-Reaktionen. LI. Notiz zur Darstellung von N,N,N′,N′-Tetramethylformamidiniumchlorid. In: Chem. Ber. Band 104, Nr. 11, 1971, S. 3714–3715, doi:10.1002/cber.19711041136.
- Z. Arnold: The preparation of tetramethylformamidinium salts and their vinylogues. In: Collect. Czech. Chem. Commun. Band 24, 1959, S. 760–765, doi:10.1135/cccc19590760.
- R.W. Alder, M.E. Blake, S. Bufali, C.P. Butts, A.G. Orpen, J. Schütz, S.J. Williams: Preparation of tetraalkylformamidinium salts and related species as precursors to stable carbenes. In: J. Chem. Soc., Perkin Trans. Band 1, 2001, S. 1586–1593, doi:10.1039/B104110J.
- A.M. Magill, K.J. Cavell, B.F. Yates: Basicity of nucleophilic carbenes in aqueous and nonaqueous solvents – theoretical predictions. In: J. Am. Chem. Soc. Band 126, Nr. 28, 2004, S. 8717–8724, doi:10.1021/ja038973x.
- Patent DE1205528: Verfahren zur Herstellung von N-substituierten Amidinen oder deren Vinylogen. Angemeldet am 8. Februar 1962, veröffentlicht am 25. November 1965, Anmelder: H. Bredereck, Erfinder: H. Bredereck, F. Effenberger, G. Simchen.
- X. Tian, T. Pape, N.W. Mitzel: Formamidinium Salts of Low Valent Metal Halide Anions MX3 – (M = Ge, Sn) and M2X62- (M = Ga, In). In: Z. Naturforsch. 59b, Nr. 11–12, 2004, S. 1524–1531, doi:10.1515/znb-2004-11-1224.
- H. Bredereck, F. Effenberger, G. Simchen: Säureamid-Reaktionen, XXXII. Über Säureamid-Dialkylsulfat-Komplexe. In: Chem. Ber. Band 96, Nr. 5, 1963, S. 1350–1355, doi:10.1002/cber.19630960526.
- Patent US3707553: Tetramethylformamidinium arenesulfonates and method of preparation. Angemeldet am 24. August 1965, veröffentlicht am 26. Dezember 1972, Anmelder: Armstrong Cork Co., Erfinder: G.E. Bagley, A.C. Poshkus.
- H. Schindlbauer: Reaktionen mit Dimethylformamid, 3. Mitt. Die Umsetzung von Arylsulfochloriden und Arylsulfonsäuren mit Dimethylformamid. In: Monatsh. Chem. Band 100, Nr. 5, 1969, S. 1590–1595, doi:10.1007/BF00900174.
- Patent US5241099: Process for the preparation of aminomethylene compounds. Angemeldet am 16. März 1992, veröffentlicht am 31. August 1993, Anmelder: Bayer AG, Erfinder: H.-U. Blank, H. Kraus.
- H. Bredereck, F. Effenberger, T. Brendle: Synthese und Reaktionen von Trisdimethylaminomethan. In: Angew. Chem. Band 78, Nr. 2, 1966, S. 147–148, doi:10.1002/ange.19660780212.
- Patent DE1217391: Verfahren zur Herstellung von Tris-dimethylaminomethan. Angemeldet am 29. September 1964, veröffentlicht am 8. Dezember 1966, Anmelder: H. Bredereck, Erfinder: H. Bredereck, F. Effenberger, T. Brendle.
- H. Bredereck, F. Effenberger, T. Brendle, H. Muffler: Orthoamide, V. Synthese von Tris-dialkylamino-methanen. In: Chem. Ber. Band 101, Nr. 5, 1968, S. 1885–1888, doi:10.1002/cber.19681010541.
- H. Gold: Die Reaktion von Cyanurchlorid mit Dimethylformamid. In: Angew. Chem. Band 72, Nr. 24, 1960, S. 956–959, doi:10.1002/ange.19600722406.
- H. Bredereck, G. Simchen, W. Kantlehner: Orthoamide, XVI. Synthese von O.N- und N.N-Acetalen der α-Keto-carbonsäure-nitrile sowie von Iminoestern. In: Chem. Ber. Band 104, Nr. 3, 1971, S. 924–931, doi:10.1002/cber.19711040331.
- H. Gold, O. Bayer: Die Darstellung basisch substituierter Malonsäure-dinitrile. In: Chem. Ber. Band 94, Nr. 10, 1961, S. 2594–2596, doi:10.1002/cber.19610941004.
- Patent EP1124783A1: Method for producing carboxylic acid chlorides. Angemeldet am 4. November 1998, veröffentlicht am 22. August 2001, Anmelder: BASF AG, Erfinder: J. Henkelmann, A. Stamm.
