Mutterkornalkaloide
Als Mutterkornalkaloide (Ergotalkaloide, Secalealkaloide) werden etwa 80 natürlich vorkommende organische Verbindungen aus der Gruppe der Indolalkaloide bezeichnet. Sie finden sich hauptsächlich im Mutterkorn, den Sklerotien des Mutterkornpilzes Claviceps purpurea, der auf Roggen und anderen Süßgräsern als Parasit wächst. Mutterkornalkaloide werden auch von weiteren Organismen, insbesondere Schlauchpilzen der Gattungen Claviceps, Neotyphodium, Epichloë, Balansia, Periglandula sowie Aspergillus und Penicillium, produziert. Diese zum Großteil toxischen Alkaloide waren die Ursache für die als Ergotismus bezeichneten epidemieartigen Vergiftungen, die vom Frühmittelalter bis zum Ende des 20. Jahrhunderts[1] auftraten. Seit dem 18. Jahrhundert wurden zunächst natürlich vorkommende Mutterkornalkaloide, später teilsynthetische Abkömmlinge als Arzneistoffe eingesetzt und dienen aktuell als Bausteine für verschiedene synthetische Drogen.[2]

Geschichte
Während aus der Antike, in der vorwiegend Weizen angebaut wurde, keine Vergiftungen durch Ergotalkaloide bekannt sind, trat der erste belegte, epidemieartige Fall von Ergotismus im Jahr 857 bei Xanten auf.[3] 922 sollen europaweit – vorwiegend in Frankreich und Spanien – etwa 40.000 Menschen einer Mutterkornepidemie zum Opfer gefallen sein.[2] 1582 nannte Lonicerus in seinem „Kräuterbuch“ Mutterkorn (Secale cornutum) als Arznei; seit dem 17. Jahrhundert wurde die Droge in Deutschland in der gynäkologischen Praxis zur Blutstillung nach der Geburt eingesetzt.[3] Trotz deutlicher Hinweise auf einen Zusammenhang zwischen der Verwendung von Mutterkorn-haltigem Mehl und dem Auftreten von Ergotismus wurden in Europa erst nach neuerlichen Epidemien in den Jahren 1770 und 1777 gesetzgeberische Maßnahmen ergriffen. In den USA erschien 1808 die erste Veröffentlichung über die Verwendung von Mutterkorn bei der Geburtseinleitung.[2]
Nachdem um 1853 der Entwicklungszyklus des Mutterkornpilzes Claviceps purpurea durch den Mykologen Edmond Tulasne aufgeklärt und beschrieben worden war,[2] extrahierte Charles Tanret 1875 aus Mutterkorn eine – allerdings ziemlich verunreinigte – Substanz, die er „Ergotinin“ nannte. Ebenso wie das „Ergotoxin“, welches 1907 entdeckt wurde, ist es ein Gemisch verschiedener Ergotalkaloide. Erst Arthur Stoll isolierte 1918 mit Ergotamin das erste reine Mutterkornalkaloid.

Mit dieser Entdeckung konnte die Lysergsäure als den meisten Mutterkornalkaloiden zugrundeliegende Basisstruktur identifiziert werden. Die übrigen Alkaloide des Mutterkorns wurden in den folgenden 25 Jahren entdeckt:
- Ergotamin-Gruppe: Ergotamin / Ergotaminin (1918), Ergosin / Ergosinin (1936)
- Ergometrin-Gruppe: Ergometrin (Ergobasin, Ergonovin) / Ergometrinin (1935)
- Ergotoxin-Gruppe: Ergokristin / Ergokristinin (1935), Ergokryptin / Ergokryptinin (1937), Ergocornin / Ergocorninin (1943), Ergostin / Ergostinin (1943)
Besondere Verdienste um die Erforschung der Mutterkornalkaloide hat sich der Schweizer Chemiker Albert Hofmann erworben, dessen Forschungen 1943 auch zur zufälligen Entdeckung des psychedelisch wirksamen Halluzinogens LSD (Lysergsäurediethylamid) führte.
Molekülstruktur
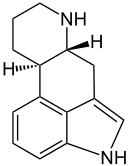
Charakteristisch für die chemische Struktur der Mutterkornalkaloide ist das tetrazyklische Ergolin. Die in der Natur gefundenen Ergoline sind am Stickstoff in Position 6 des Ergolinsystems methyliert und weisen insbesondere in Position 8 weitere Substituenten auf. Das Ergolingrundgerüst der Mehrheit der Mutterkornalkaloide weist darüber hinaus zwischen C9 und C10 eine Doppelbindung auf. Anhand ihres Substitutionsmusters können Mutterkornalkaloide in vier Gruppen unterteilt werden:
- Clavine
- Lysergsäuren
- einfache Lysergsäureamide und
- Peptidalkaloide.
Clavine
Clavine, wie z. B. Lysergol, leiten sich im Gegensatz zu allen übrigen natürlich vorkommenden Ergolinen nicht von der Lysergsäure ab, sondern von dessen Vorstufen mit einer niedrigeren Oxidationsstufe (z. B. Alkohole).
Das Mutterkorn enthält die Clavine Agroclavin, Elymoclavin, Molliclavin, Lysergin, Lysergol, Lysergen, Setoclavin, Isosetoclavin, Penniclavin, Isopenniclavin, Festuclavin, Pyroclavin, Costaclavin und Fumigaclavin A u. B. Ebenso können sogenannte Secoergoline ohne vollständige Ergolinstruktur, wie z. B. Chanoclavin, nachgewiesen werden. Sie sind biogenetische Vorstufen der Clavine.
Lysergsäuren
Lysergsäuren, wie z. B. Lysergsäure und Paspalsäure, sind Endprodukte oder einfache Zwischenprodukte in der Biosynthese höherer Mutterkornalkaloide.
Einfache Lysergsäureamide
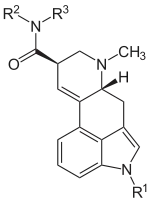
Einfache Lysergsäureamide, wie z. B. Ergometrin, werden durch den Mutterkornpilz durch Kondensation von Lysergsäure und einer Aminosäure (z. B. Alanin) gebildet. Andere einfache Lysergsäureamide, wie z. B. Ergin (Lysergsäureamid), sind Abbauprodukte höherer Mutterkornalkaloide.
| Name | Substituent R1 | Substituent R2 | Substituent R3 |
|---|---|---|---|
| Ergin | –H | –H | –H |
| LSH | –H | –CH3CHOH | –H |
| Ergometrin | –H | –CH(CH3)CH2OH | –H |
| Methylergometrin* | –H | –CH(CH2CH3)CH2OH | –H |
| Methysergid* | –CH3 | –CH(CH2CH3)CH2OH | –H |
| LSD* | –H | –CH2CH3 | –CH2CH3 |
| ALD-52* | –C(O)CH3 | –CH2CH3 | –CH2CH3 |
| 1P-LSD* | –C(O)CH2CH3 | –CH2CH3 | –CH2CH3 |
| 1CP-LSD* | –C(O)C3H5 | –CH2CH3 | –CH2CH3 |
| 1B-LSD* | –C(O)CH2CH2CH3 | –CH2CH3 | –CH2CH3 |
* Methylergometrin, Methysergid, sowie LSD und seine Analoga (ALD-52, 1P-LSD, 1CP-LSD und 1B-LSD) sind keine Mutterkornalkaloide im eigentlichen Sinne, sondern teilsynthetisch hergestellte Derivate dieser.
Peptidalkaloide
Peptidalkaloide sind Kondensationsprodukte aus der Lysergsäure und einem in der Regel trizyklischen Tripeptid. Man unterscheidet zwischen:
- Ergopeptinen und
- Ergopeptamen
Die Ergopeptine teilt man nach der unmittelbar an der D-Lysergsäure gebundenen Aminosäure ein in Vertreter der:
- Ergotamin-Gruppe (erste Aminosäure ist hier L-Alanin, z. B.: Ergotamin, Ergovalin, α-Ergosin, β-Ergosin)
- Ergotoxin-Gruppe (erste Aminosäure ist hier L-Valin, z. B.: Ergocristin, Ergocornin, α-Ergokryptin, β-Ergokryptin)
- Ergoxin-Gruppe (erste Aminosäure ist hier α-Aminobuttersäure, z. B.: Ergostin, Ergonin, α-Ergoptin, β-Ergoptin[4])
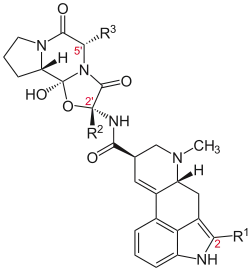
Ergopeptine sind die formenreichste Gruppe der Mutterkornalkaloide. Der bekannteste Vertreter ist Ergotamin, das Hauptalkaloid des Mutterkorns. Des Weiteren konnten die Ergopeptine Ergocornin, Ergocristin, α-Ergokryptin, β-Ergokryptin, Ergovalin, α-Ergosin und β-Ergosin als Inhaltsstoffe des Mutterkorns identifiziert werden. Ergovalin ist ein Hauptalkaloid der endophytisch in Weidegräsern wachsenden Neotyphodium- und Epichloë-Arten und von veterinär-toxikologischer Bedeutung (Fescue toxicosis). 9,10-Dihydroergopeptine sind in der Natur sehr selten und konnten bisher nur in Sphacelia sorghi und Claviceps africana nachgewiesen werden.[5] Partialsynthetisch gewonnene Dihydroergopeptine, wie z. B. Dihydroergotamin und Dihydroergotoxin, besitzen eine therapeutische Bedeutung in der Behandlung von Migräne und Herz-Kreislauferkrankungen.
| Ergopeptin | Substituent R2 (Pos. 2′) | Substituent R3 (Pos. 5′) |
|---|---|---|
| Ergotamin | CH3 | CH2C6H5 |
| Ergovalin | CH3 | CH(CH3)2 |
| α-Ergosin | CH3 | CH2CH(CH3)2 |
| β-Ergosin | CH3 | CH(CH3)(C2H5) |
| Ergocristin | CH(CH3)2 | CH2C6H5 |
| Ergocornin | CH(CH3)2 | CH(CH3)2 |
| α-Ergokryptin | CH(CH3)2 | CH2CH(CH3)2 |
| β-Ergokryptin | CH(CH3)2 | CH(CH3)(C2H5) |
Bei Ergopeptamen ist der Oxazolid-Ring der ersten Aminosäure geöffnet (Zwischen 1' und 2').
Partialsynthetische Modifikationen
Basierend auf den natürlich vorkommenden Mutterkornalkaloiden wurden zahlreiche modifizierte Ergoline entwickelt. Das früher verwendete Migräneprophylaktikum Methysergid leitet sich vom einfachen Lysergsäureamid Ergometrin ab. Das ebenfalls in der Migränetherapie verwendete Dihydroergotamin wird durch Hydrierung aus Ergotamin gewonnen. Isoergoline (Suffix: -inin, z. B. Ergotaminin) unterscheiden sich stereochemisch von Ergolinen durch einen α-ständigen Substituenten in Position 8 des Ergolingrundgerüstes. Isoergoline entstehen aus Ergolinen durch Isomerisierungsreaktionen in wässriger Lösung. Sie sind meist Abbauprodukte oder Aufarbeitungsartefakte bei der Isolierung von Mutterkornalkaloiden. Sie besitzen in der Regel eine geringere pharmakologische Aktivität. Dem gegenüber stellen einige partialsynthetische Isoergoline, wie z. B. Lisurid und Tergurid, hochpotente Arzneistoffe in der Therapie der Parkinson-Krankheit dar.
Vorkommen

Die wichtigsten Produzenten von Mutterkornalkaloiden sind die Mutterkornpilze aus der Familie der Clavicipitaceae. Dazu zählen neben Claviceps purpurea, Claviceps paspali, Claviceps fusiformis insbesondere auch Vertreter der Gattungen Balansia und Epichloë/Neotyphodium. Diese Pilze leben als Epibionten und Endophyten auf mehr als 600 Pflanzenarten der Familien Süßgräser, Binsengewächse und Sauergrasgewächse. Viele Vertreter der Gattung Balansia produzieren selektiv Clavinalkaloide. Das durch Claviceps und Epichloë/Neotyphodium produzierte Spektrum an Mutterkornalkaloiden ist umfangreicher. In Gräsern, die von Neotyphodium coenophialum befallen wurden, kann neben einfachen Mutterkornalkaloiden auch das Ergopeptin Ergovalin nachgewiesen werden. Claviceps purpurea wächst bevorzugt auf Roggen, er kann jedoch auch auf anderen Getreide- und Wildgräserarten parasitieren. Der Gehalt an Mutterkornalkaloiden in seinem Sklerotium, dem Mutterkorn, liegt zwischen etwa 0,2–1 % der Trockenmasse und umfasst alle vier Gruppen dieser Stoffklasse. Es gibt Höchstmengen für Mutterkornalkaloide in Roggenbrot. Weitere Produzenten von Mutterkornalkaloiden sind Schlauchpilze der Gattungen Penicillium und Aspergillus.[6][7]

Mutterkornalkaloide, von Clavinen bis hin zu einfachen Ergopeptinen, konnten auch in verschiedenen Vertretern der Windengewächse, wie beispielsweise der Himmelblauen Prunkwinde, nachgewiesen werden. Hier gelten sie als eine Ursache für deren psychotrope Eigenschaften und deren Toxizität. Für das Vorkommen von Mutterkornalkaloiden in Windengewächsen wurde ein Befall mit Mutterkornpilzen diskutiert.[8] Als Produzenten dieser Alkaloide in Windengewächsen konnten schließlich Mutterkornpilze der bis dahin unbekannten Gattung Periglandula identifiziert werden.[9]
Auch über ein Vorkommen von Clavinen in anderen Abteilungen der Pilze, einschließlich der Jochpilze und Ständerpilze, wurde vereinzelt berichtet.[10]
Medizinische Verwendung
Wegen ihrer pharmakodynamischen Wirkungen sind einige Mutterkornalkaloide in der Medizin u. a. zur Behandlung von Migräne, peripheren Durchblutungsstörungen, der Parkinson-Krankheit und des Restless-Legs-Syndroms relevant bzw. werden als Wehenmittel und Antihypertensiva eingesetzt. Auch in der Tiermedizin finden sie Anwendung.
Pharmakologische Eigenschaften
Die Wirkungen der Mutterkornalkaloide sind vielfältig. Sie können die Dopamin-Rezeptoren stimulieren und die Ausschüttung von Prolaktin und Somatotropin hemmen. Sie sind partielle Agonisten an den Serotonin-Rezeptoren. Auf die Uterusmuskulatur haben sie eine kontrahierende Wirkung (v. a. Ergometrin); auf diese seit langem bekannte Wirkung geht auch der Name „Mutterkorn“ zurück. Besonders natürlichem Ergotamin ist eine vasokonstriktorische Wirkung eigen. Die hydrierten Ergotamine blockieren die α-Adrenorezeptoren, was unter bestimmten Umständen kontrahierte Gefäße erweitern kann.
Mutterkornalkaloide
- Ergometrin: Laktationshemmung, Blutstillung (besonders im Uterus)
- Ergotamin (Ergo-Kranit): Migräne, arterielle Hypertonie, Durchblutungsstörungen, Arrhythmie, Emetikum (i.v.)
Derivate von Mutterkornalkaloiden
- Bromocriptin (z. B. Pravidel, Bromocrel): Parkinson-Krankheit, Akromegalie, Hyperprolaktinämie, Restless-Legs-Syndrom, Laktationshemmung / Scheinträchtigkeit (Hund)
- Cabergolin (Cabaseril, Dostinex, Galastop): Parkinson-Krankheit, Hyperprolaktinämie, Restless-Legs-Syndrom, primäres Abstillen, Scheinträchtigkeit bei Hunden
- Dihydroergotamin (z. B. Ergomimet): Orthostatische Dysregulation, Krampfadern (Varizen), Hypotonie, Migräne (auch zur Prophylaxe)
- Dihydroergocryptin (Almirid, Cripar): Parkinson-Krankheit
- Dihydroergotoxin (z. B. Hydergin, Sponsin, Orphol): Durchblutungsstörungen, arterielle Hypertonie, Demenz, Migräne
- Lisurid (Dopergin): Parkinson-Krankheit, Akromegalie, Hyperprolaktinämie, Laktationshemmung, Restless-Legs-Syndrom
- Methylergometrin (Methergin): Laktationshemmung, Blutstillung (besonders im Uterus)
- Pergolid (Parkotil): Parkinson-Krankheit, Restless-Legs-Syndrom
Rechtliches
Das deutsche Grundstoffüberwachungsgesetz schränkt die Abgabe von Ergotamin ein: es könnte nämlich als Basis zur Herstellung von LSD, einem in Deutschland verbotenen Betäubungsmittel, verwendet werden. Zusammen mit Ergometrin fällt es auch unter das „Übereinkommen der Vereinten Nationen vom 20. Dezember 1988 gegen den unerlaubten Verkehr mit Suchtstoffen und psychotropen Stoffen (Suchtstoffübereinkommen)“.
Im Hinblick auf Lebens- und Futtermittel wurden mit der EU-Verordnung 2021/1399 mit Wirkung zum 1. Januar 2022 Höchstgehalte von Mutterkornalkaloiden in Getreideerzeugnissen festgelegt. So dürfen bei Abgabe an den Endabnehmer bzw. Verbraucher beispielsweise Roggenmehl und -körner nicht mehr als 500 μg/kg enthalten. Ab 1. Juli 2024 gilt ein abgesenkter Höchstwert von 250 μg/kg. Die Gehalte sind definiert als Summe aus Ergotamin, Ergometrin, Ergosin, Ergocristin, Ergocryptin und Ergocornin und deren Epimeren.[11]
Literatur
- Albert Hofmann: Die Mutterkornalkaloide. Vom Mutterkorn zum LSD. Die Chemie der Mutterkornalkaloide. Nachtschatten, o. O. 2000 (Nachdr. v. 1964), ISBN 3-907080-64-5.
- Otto Kraupp, Fred Lembeck (Hrsg.): Mutterkornalkaloide heute. Therapeutische Konsequenzen einer chemisch-pharmakologischen Differenzierung im Lichte neuer Forschungsergebnisse. Thieme, Stuttgart 1982, ISBN 3-13-621001-8.
- Claudia Arntz: Molekularbiologische Untersuchungen zur Alkaloidsynthese bei Claviceps. Cramer, Berlin u. a. 1999.
- Julia Groß: Untersuchungen zum Vorkommen von Ergolinen in höheren Pflanzen der Familie der Convolvulaceae und in endophytischen Pilzen. Diss. Bonn 2004.
- Andrea Sinz: Die Bedeutung der Mutterkorn-Alkaloide als Arzneistoffe. Pharmazie in unserer Zeit 37(4), S. 306–309 (2008), doi:10.1002/pauz.200700273
- Eberhart Teuscher, Matthias F. Melzig, Ulrike Lindequist: Biogene Arzneimittel, ISBN 3-8047-2073-0.
Weblinks
Einzelnachweise
- Eintrag zu Mutterkorn-Alkaloide im Lexikon der Ernährung, Wissenschaft-Online-Lexika, abgerufen am 9. November 2011.
- Eintrag zu Ergot-Alkaloide. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. November 2011.
- Eintrag zu Mutterkorn im Lexikon der Arzneipflanzen und Drogen, Wissenschaft-Online-Lexika, abgerufen am 10. November 2011.
- Christopher L. Schardl, Daniel G. Panaccione and Paul Tudzynski: ERGOT ALKALOIDS - BIOLOGY AND MOLECULAR BIOLOGY. In: Geoffrey A. Cordell (Hrsg.): THE ALKALOIDS. 1. Auflage. Band 63. Academic Press/Elsevier, Amsterdam, Boston, Heidelberg, London, Oxford, Paris, San Diego, San Francisco, Singapore, Sidney, Tokio 2006, ISBN 978-0-12-469563-4, Kap. 2, S. 45–86.
- Debra E. Frederickson, Peter G. Mantle: Claviceps africana sp. nov.; the distinctive ergot pathogen of sorghum in Africa. In: Mycol. Res. 93, Nr. 9, März, S. 1101–1107.
- M. Isaka, P. Kittakoop, Y. Thebtaranonth: Secondary Metabolites of Clavicipitalean Fungi. In: James Francis White (Hrsg.): Clavicipitalean fungi: evolutionary biology, chemistry, biocontrol, and cultural impacts. CRC Press, 2003, ISBN 0824742559, S. 25–56.
- Klaus B. Tenberge: Biology and Life Strategy of the Ergot Fungi. In: Vladimír Křen, Ladislav Cvak (Hrsg.): Ergot: the genus Claviceps. CRC Press, 1999, ISBN 9789057023750, S. 411–440.
- Eckart Eich: Tryptophan-derived Alkaloids. In: Solanaceae and convolvulaceae – secondary metabolites: biosynthesis, chemotaxonomy, biological and economic significance. Springer, 2008, ISBN 3540745408, S. 213–260.
- Steiner U, Leibner S, Schardl CL, Leuchtmann A, Leistner E: Periglandula, a new fungal genus within the Clavicipitaceae and its association with Convolvulaceae. In: Mycologia. 103, Nr. 5, 2011, S. 1133–1145. doi:10.3852/11-031. PMID 21558502.
- Anatoly G. Kozlovsky: Producers of ergot alkaloids out of the Claviceps genus. In: Vladimir Kren, Ladislav Cvak (Hrsg.): Ergot: The Genus Claviceps. Medicinal and Aromatic Plants – Industrial Profiles. CRC Press, 2004, ISBN 0203304195, S. 479–499.
- Verordnung (EU) 2021/1399 der Kommission vom 24. August 2021 zur Änderung der Verordnung (EG) Nr. 1881/2006 hinsichtlich der Höchstgehalte an Mutterkorn-Sklerotien und Ergotalkaloiden in bestimmten Lebensmitteln. Online auf dem Rechtsportal der EU, abgerufen am 23. Januar 2022.