Lysergol
Lysergol ist eine natürlich vorkommende chemische Verbindung. Es ist ein zur Gruppe der Clavine zählendes Alkaloid, welches von zahlreichen auf Süßgräsern parasitierenden Vertretern der Mutterkornpilzverwandten und anderen Schlauchpilzen produziert wird. Darüber hinaus ist Lysergol in zahlreichen Windengewächsen zu finden.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
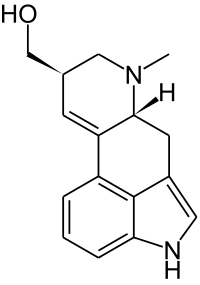 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lysergol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C16H18N2O | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 254,3 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
ca. 245 °C (unter Zersetzung)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Lysergol und sein C-8-Epimer Isolysergol wurden 1949 erstmals von Arthur Stoll, Albert Hofmann und Werner Schlientz partialsynthetisch hergestellt und beschrieben.[3] Das natürliche Vorkommen des Lysergols konnte 1960 von Yamatodani mit Hilfe der Papierchromatographie nachgewiesen werden.[4]
Vorkommen
Lysergol wurde zuerst auf Elymus semicostatus, einer Queckenart, nachgewiesen. Für die Produktion dieses Alkaloids ist der Befall mit Mutterkornpilzen verantwortlich. Lysergol kann auch aus einer saprophytischen Kultur von Mutterkornpilzen gewonnen werden.[2] Besonders auffällig ist das Vorkommen von Lysergol neben anderen Clavinen in Windengewächsen.[5]
Im geringen Maße ist es Bestandteil des toxischen Prinzips und der psychotropen Wirkung der rituell genutzten Windengewächsdrogen Ololiuqui (insbesondere aus Turbina corymbosa) und Tlitliltzin (Ipomoea violacea und andere Ipomoea-Arten) neben den primären Wirkungssubstanzen LSA und LSH. Für das Vorkommen von Clavinen, wie Lysergol, in Windengewächsen wird ein Befall mit Mutterkornpilzen der Gattung Periglandula verantwortlich gemacht.[6]
Darstellung
Partialsynthetische Darstellung
Lysergol kann partialsynthetisch aus der Lysergsäure hergestellt werden. Lysergol ist das Reaktionsprodukt der Reduktion von Lysergsäuremethylester mit Lithiumaluminiumhydrid (LiAlH4).[3]
Totalsynthese
Lysergol kann enantioselektiv in einem mehrstufigen Prozess ausgehend von Ethinylaziridin und 4-Bromindol-3-yl-acetaldehyd unter Palladium-vermittelter Domino-Zyklisierung hergestellt werden.[7] Im ersten Reaktionsschritt wird mit einer Tosylgruppe geschütztes Ethinylaziridin mit Formaldehyd unter Palladium- und Indium-Katalyse reduktiv zum entsprechenden chiralen 1,3-Aminoalkohol umgesetzt. Das Chiralitätszentrum des Aminoalkohols entspricht dem späteren Stereozentrum in Position C-8 des Lysergols. Im Sinne einer Nozaki-Hiyama-Kishi-Reaktion mit 4-Bromindol-3-yl-acetaldehyd wird unter Nickel- und Chrom-Katalyse als Zwischenprodukt das tosylierte 1-(4-Bromindol-3-yl)-4-(2-phenyl-1,3-oxazinan-5-yl)-butin-2-ol gewonnen. Aus dem aus dieser Verbindung gewonnenen Allen geht in der anschließenden Dominozyklisierung unter Palladium-Katalyse das Ergolin-Grundgerüst hervor. Nach Entfernung der Schutzgruppen kann das Lysergol isoliert werden.
Eigenschaften
Chemische und physikalische Eigenschaften
Lysergol ist eine farblose weißliche bis leicht gelbliche Substanz. Es ist in Methanol und Ethanol löslich, in Chloroform und Wasser hingegen nur sehr schwerlöslich.[3] Aus Ethanol kristallisiert sie in Form von Prismen.[2]
Lysergol gibt die typischen Nachweisreaktionen auf Mutterkornalkaloide. Dazu zählen insbesondere die Van-Urk-Reaktion und der Nachweis mit dem Allport-Cocking-Reagenz. Das UV-Spektrum der Substanz zeigt Maxima bei 225, 242 und 312 nm.[2]
Stereochemie
Lysergol ist ein chiraler Naturstoff mit zwei Asymmetriezentren. Es besitzt eine all-(R)-Konfiguration. Sein C-8-Epimer, das Isolysergol, konnte ebenfalls als Naturstoff nachgewiesen werden.[8] Ohne Bedeutung ist hingegen das C-5-Epimer.
Biologische Bedeutung
Lysergol zählt zu den pharmakologisch aktivsten Verbindungen aus der Gruppe der Clavine. Lysergol besitzt eine hohe Affinität zu 5-HT1-Rezeptoren, insbesondere zu 5-HT1B-, 5-HT1D- und 5-HT1F-Rezeptoren.[9] An 5-HT1B-Rezeptoren wirkt Lysergol als ein potenter Partialagonist.[10] Mit geringerer Potenz aktiviert Lysergol auch 5-HT2A-Rezeptoren. Dem gegenüber ist Lysergol ein Antagonist an α1-Adrenozeptoren mit moderater Rezeptoraffinität.[11] An α2-Adrenozeptoren wirkt Lysergol als ein Partialagonist.[12] Bei der Weideviehkrankheit Fescue toxicosis, die durch das Abweiden von Gräsern, die mit Mutterkornpilzen befallen wurden, entsteht, wird Lysergol als eine entscheidende Komponente angesehen.[13] Auf Grund des starken Nebenwirkungsprofil (wie z. B. Erhöhung des Blutdrucks) besitzt Lysergol keine Relevanz als psychotrope Substanz.[14]
Einzelnachweise
- Datenblatt Lysergol, 97% bei Sigma-Aldrich, abgerufen am 31. Oktober 2013 (PDF).
- Abe M, Yamatodani S, Yamano T, Kosumoto M: Isolation of lysergol, lysergene and lysergine from the saprophytic cultures of ergot fungi. In: Agr. Biol. Chem. 25, 1961, S. 594–595.
- Stoll A, Hofmann A, Schlientz W: Die stereoisomeren Lysergole und Dihydro-lysergole. 15. Mitteilung über Mutterkornalkaloide. In: Helv. Chim. Acta. 32, Nr. 6, 1949, S. 1947–1956. doi:10.1002/hlca.19490320622.
- Yamatodani S: Researches on ergot fungus. Part XL. On the paper chromatography of water-soluble ergot alkaloids. In: Ann. Rep. Takeda Res. Lab. 19, 1960, S. 1–7.
- Eckart Eich: Tryptophan-derived Alkaloids. In: Solanaceae and convolvulaceae – secondary metabolites: biosynthesis, chemotaxonomy, biological and economic significance. Springer, 2008, ISBN 3540745408, S. 213–260.
- Steiner U, Leibner S, Schardl CL, Leuchtmann A, Leistner E: Periglandula, a new fungal genus within the Clavicipitaceae and its association with Convolvulaceae. In: Mycologia. 103, Nr. 5, 2011, S. 1133–1145. doi:10.3852/11-031. PMID 21558502.
- Inuki S, Iwata A, Oishi S, Fujii N, Ohno H: Enantioselective total synthesis of (+)-lysergic acid, (+)-lysergol, and (+)-isolysergol by palladium-catalyzed domino cyclization of allenes bearing amino and bromoindolyl groups. In: J Org Chem. 76, Nr. 7, 2011, S. 2072–2083. doi:10.1021/jo102388e. PMID 21361331.
- Agurell S: Isolysergol from saprophytic cultures of ergot. In: Acta Pharm. Suecica. 3, 1966, S. 7–10.
- Heinz Pertz, Eckart Eich: Ergot alkaloids and their derivatives as ligands for serotoninergic, dopaminergic, and adrenergic receptors. In: Vladimir Kren, Ladislav Cvak (Hrsg.): Ergot: The Genus Claviceps. Medicinal and Aromatic Plants – Industrial Profiles. CRC Press, 2004, ISBN 0203304195, S. 411–440.
- Pertz H: 5-Hydroxytryptamine (5-HT) contracts the guinea-pig isolated iliac artery via 5-HT1-like and 5-HT2 receptors. In: Naunyn Schmiedebergs Arch Pharmacol. 348, Nr. 6, 1993, S. 558–565. PMID 8133899.
- Pertz H: Naturally occurring clavines: antagonism/partial agonism at 5-HT2A receptors and antagonism at alpha 1-adrenoceptors in blood vessels. In: Planta Med. 62, Nr. 5, 1996, S. 387–392. PMID 8923801.
- Fallarero A, Pohjanoksa K, Wissel G, Parkkisenniemi-Kinnunen UM, Xhaard H, Scheinin M, Vuorela P: High-throughput screening with a miniaturized radioligand competition assay identifies new modulators of human α2-adrenoceptors. In: Eur J Pharm Sci. 47, Nr. 5, 2012, S. 941–951. doi:10.1016/j.ejps.2012.08.021. PMID 2298240.
- Hill NS, Thompson FN, Stuedemann JA, Rottinghaus GW, Ju HJ, Dawe DL, Hiatt EE 3rd: Ergot alkaloid transport across ruminant gastric tissues. In: J Anim Sci. 79, Nr. 2, 2001, S. 542–549. PMID 11219466.
- H. Panda: Handbook on Drugs from Natural Sources. ASIA PACIFIC BUSINESS PRESS Inc., 2010, ISBN 978-8-178-33133-1 (eingeschränkte Vorschau in der Google-Buchsuche).
