Clavine
Clavine (auch Clavin-Alkaloide) sind zu den Alkaloiden zählende, tri- und tetrazyklische chemische Verbindungen. Clavine werden vom namensgebenden Mutterkornpilz Claviceps purpurea und weiteren Schlauchpilzen der Gattungen Aspergillus, Claviceps, Balansia, Epichloë, Neotyphodium, Penicillium und Periglandula produziert. Auf Grund ihres Vorkommens im Mutterkorn und ihrer chemischen Verwandtschaft zu den anderen, von der Lysergsäure abgeleiteten Alkaloiden, werden sie den Mutterkornalkaloiden zugeordnet.
Vorkommen

Clavine werden insbesondere von Schlauchpilzen aus der Familie der Clavicipitaceae gebildet.[1] Zu ihnen zählen die Vertreter der Gattungen Claviceps, Balansia und Epichloë/Neotyphodium. Von Bedeutung ist insbesondere das Vorkommen im Mutterkorn, dem Sklerotium des Mutterkornpilzes Claviceps purpurea auf Roggen und anderen Süßgräsern. Die Clavine sind neben den einfachen Amiden der Lysergsäure und den Mutterkornalkaloiden vom Peptid-Typ für die Toxizität des Mutterkorns mitverantwortlich.
Als überraschend wurde lange Zeit das isolierte Vorkommen von Clavinen und anderen Mutterkornalkaloiden in Windengewächsen (Convolvulaceae), einer phylogenetisch zu den Schlauchpilzen weit entfernten Pflanzenfamilie, angesehen. Ein möglicher Befall der Pflanzen mit Mutterkornpilzen wurde daher diskutiert.[2] Genetische Untersuchungen zeigten, dass eine bislang unbekannte Mutterkornpilzgattung namens Periglandula für die Produktion dieser Alkaloide verantwortlich ist.[3]
Ohne eine Mitwirkung von Mutterkornpilzen können Clavine auch von einigen Vertretern der nicht in direkter Verwandtschaft zu den Clavicipitaceae stehenden Familie der Trichocomaceae produziert werden. Wichtige Produzenten von Clavinalkaloiden sind innerhalb dieser Familie die Vertreter der Gattungen Aspergillus und Penicillium. Auch über das Vorkommen von Clavinen in anderen Abteilungen der Pilze, einschließlich der Jochpilze und Ständerpilze, wurde vereinzelt berichtet.[4]
Struktur
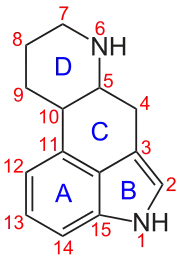
Clavine sind von der Aminosäure Tryptophan abgeleitete Indolalkaloide. Sie besitzen ein tetrazyklisches Grundgerüst, das Ergolin-Grundgerüst, oder ein D-Ring-geöffnetes trizyklisches Grundgerüst (Secoergoline) oder ein durch alternative Ringverknüpfung entstandenes tri- oder tetrazyklisches Ringsystem. Gelegentlich werden auch Alkaloide mit einem erweiterten pentazyklischen Ringsystem und einige bizyklische Vorstufen der Biosynthese von Lysergsäure im Zusammenhang mit Clavinen erwähnt. Definitionsgemäß unterscheiden sich Clavine von den übrigen Mutterkornalkaloiden, die sich von der Lysergsäure ableiten, durch eine niedrigere Oxidationsstufe des Kohlenstoffatoms, das dem Substituenten in Position 8 der Lysergsäure entspricht.
Secoergoline
Tricyclische Clavine, chemisch auch als Secoergoline bezeichnet, stellen Zwischenprodukte (und davon abgeleitete Substanzen) in der Biosynthese tetrazyklischer Mutterkornalkaloide dar. Der Ringschluss im Ring D zwischen N-6 und C-7 ist bei trizyklischen Clavinen noch nicht erfolgt. Zu den trizyklischen Clavinen zählen beispielsweise die Chanoclavine I und II, Paliclavin, Secolysergin und Secoagroclavin.
Ergoline
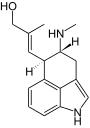 | |
| Chanoclavin I | |
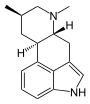 | 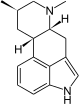 |
| Festuclavin | Costaclavin |
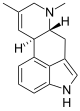 | 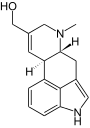 |
| Agroclavin | Elymoclavin |
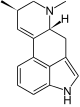 | 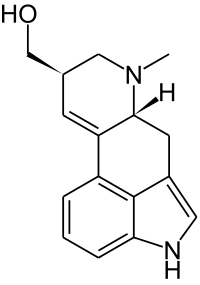 |
| Lysergin | Lysergol |
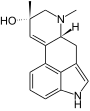 | 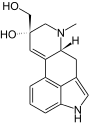 |
| Setoclavin | Penniclavin |
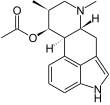 | 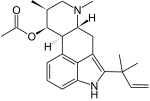 |
| Fumigaclavin A | Fumigaclavin C |
Die tetrazyklischen Clavine mit einem Ergolingrundgerüst stellen die zahlenmäßige Mehrheit innerhalb der Familie der Clavinalkaloide dar. Sie unterscheiden sich untereinander insbesondere durch das Fehlen oder das Vorhandensein einer Doppelbindung im Ring D sowie durch die Substituenten in Position 8 des Ergolinsystems.
Dihydroclavine
Dihydroclavine unterscheiden sich von den übrigen Mutterkornalkaloiden durch das Fehlen einer Doppelbindung in Ring D. Dementsprechend besitzen Dihydroclavine drei anstatt zwei Stereozentren. Innerhalb der Clavicipitaceae kommen insbesondere Festuclavin, sein C-8-Epimer Pyroclavin und sein C-10-Epimer Costaclavin vor. Weitere Dihydroclavine, wie beispielsweise Dihydroelymoclavin konnten aus Kulturen von Claviceps africana isoliert werden. Auch die Fumigaclavine aus Aspergillus- und Penicillium-Arten zählen zu den Dihydroclavinen.
Δ8,9-Ergolene
Δ8,9-Ergolene zeichnen sich durch eine Doppelbindung im D-Ring des Ergolingrundgerüsts zwischen C-8 und C-9 aus. Zu den Clavinen mit einer Δ8,9-Ergolenstruktur zählen beispielsweise Agroclavin, Elymoclavin und Molliclavin.
Δ9,10-Ergolene
Δ9,10-Ergolene besitzen eine Doppelbindung im D-Ring des Ergolingrundgerüsts zwischen C-9 und C-10. Zu den Clavinen mit einer Δ9,10-Ergolenstruktur zählen u. a. Lysergin, Lysergen, Lysergol, Setoclavin und Penniclavin.
Substituenten am C-8
Bei Dihydroclavinen und Clavinen mit einem Δ9,10-Ergolengrundgerüst kann (mit Ausnahme von Lysergen) aufgrund ihres Asymmetriezentrums in Position 8 zwischen Substituenten in 8α- und 8β-Position unterschieden werden. Die Methyl- oder Hydroxymethylgruppe befindet sich in Position 8β bei der Mehrheit der Clavine der Clavicipitaceae. Einige Clavine, wie beispielsweise Setoclavin und Penniclavin, tragen in Position 8α eine zusätzliche Hydroxygruppe. Clavine mit einer α-ständigen Methyl- oder Hydroxymethylgruppe zählen zu den Isoergolinen. Beispiele hierfür sind Isolysergol, Isopenniclavin und die Isofumigaclavine.
Zusätzliche Substituenten
Die tetrazyklischen Clavine der Clavipitaceae weisen, abgesehen von Substituenten am C-8, ein weitgehend unmodifiziertes N-6-Methylergolin- oder N-6-Methylergolensystem auf. Lediglich Molliclavin verfügt über eine Hydroxygruppe an C-9.[5] Die Fumigaclavine, welche insbesondere von Aspergillus- und Penicillium-Arten gebildet werden, unterscheiden sich von den meisten Clavinen der Clavicipitaceae durch zusätzliche Substituenten. Strukturell leiten sich die Fumigaclavine vom Festuclavin ab. Sie verfügen über zusätzliche Hydroxy- (Fumigaclavin B) oder Acetoxygruppe (Fumigaclavine A und C) am C-9 des Ergolinsystems. Fumigaclavin C trägt am C-2 darüber hinaus einen zusätzlichen Dimethylallylylsubstituenten.
Ein weiteres Beispiel für Clavine mit zusätzlichen Substituenten ist das Cividiclavin, ein natürlich vorkommendes C-13-N'-1-Pyroclavindimer mit einer Hydroxygruppe an C-14 aus Penicillium citreo-viride.[6]
Alternative Ringsysteme
Einige mit klassischen Clavinen biosynthetisch verwandte Alkaloide besitzen ein vom Secolergolin- oder Ergolingrundgerüst abweichendes, durch alternative Ringverknüpfung entstandenes tri-, tetra- oder pentazyklisches Ringsystem. Die Zuordnung dieser Alkaloide zu den Clavinen wird in der wissenschaftlichen Literatur unterschiedlich gesehen.[7][8]
Abweichend von anderen trizyklischen Clavinen besitzen Clavicipitinsäure aus Claviceps fusiformis[9] und Aurantioclavin aus Penicillium aurantiovirens[10] ein trizyklisches Azepinoindol-Grundgerüst, das durch alternative Ringverknüpfung entstanden ist.
Ebenfalls durch alternative Ringverknüpfung entstehen das tetrazyklisches 8-Oxergolin Paspaclavin aus Claviceps paspali[11] und die insbesondere von verschiedenen Penicillium-Arten produzierten Rugulavasine mit ihrem Spiro-Benzoindolfuran-Ringsystem.
Dem gegenüber ist die Verwandtschaft zu klassischen Clavinen bei den pentazyklischen Alkaloiden Epoxyagroclavin aus Penicillium kapuscinski und Cycloclavin aus Aspergillus japonicus deutlich ersichtlich. Sie stellen formal Oxidationsprodukte des Agroclavins dar.[8] Dagegen weicht die Struktur der ebenfalls pentazyklischen Cyclopiazonsäure aus Penicillium cyclopium deutlich von der Ergolinstruktur ab.[12]
Biosynthese
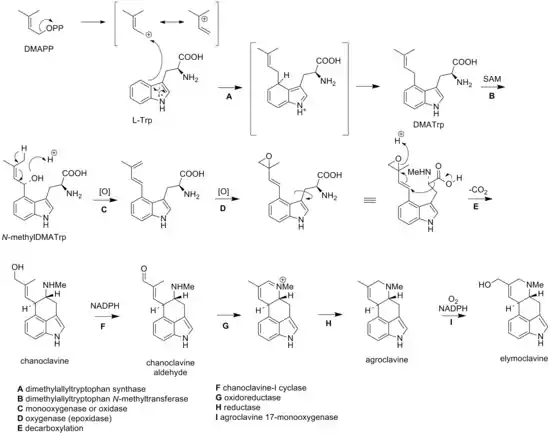
Die Biosynthese der Clavine wird durch eine Reihe von Enzymen, die durch einen Cluster sogenannter EAS-Gene (ergot alkaloid synthesis genes = Mutterkornalkaloidsynthesegene) kodiert werden, katalysiert.[13] Ein solcher Gen-Cluster konnte bei allen bisher untersuchten Produzenten von Clavinen nachgewiesen werden. Auf Grund der Gemeinsamkeit vieler beteiligten Enzyme verläuft die Biosynthese speziesübergreifend im Wesentlichen nach einem gemeinsamen Schema.[14]
In einem ersten Reaktionsschritt wird die Aminosäure Tryptophan mit Dimethylallylpyrophosphat unter Beteiligung des Genprodukts von dmaW, der Dimethylallyltryptophansynthase, zu Dimethylallyltryptophan prenyliert. Eine Methyltransferase katalysiert die N-Methylierung zu N-Methyldimethylallyltryptophan. Der Ringschluss des C-Rings zu Chanoclavin-I erfolgt unter Katalyse der Chanoclavinsynthase. Eine Reduktion der Hydroxygruppe führt zu Secolysergin. Eine Oxidation von Chanoclavin-I hingegen führt zum Chanoclavin-I-aldehyd, welches unter Beteiligung der durch das easA-Gen kodierten Chanoclavincyclase und unter Ringschluss des D-Rings zum Agroclavin zyklisiert wird. Ein Ringschluss des D-Rings unter Beteiligung einer Chanoclavincyclase mit Reduktase-Funktion führt zum Festuclavin und den von ihm abgeleiteten Fumigaclavinen aus Aspergillus fumigatus[15] und Dihydroclavinen aus Claviceps africana. Paspaclavin hingegen ist das Produkt eines alternativen Schlusses des D-Rings.
Eine Oxidation der Methylgruppe am C-8 des Agroclavins zu einer Hydroxymethylgruppe unter Beteiligung einer Monooxygenase führt zum Elymoclavin. Eine weitere Oxidation des Substituenten am C-8, welche ein intaktes cloA-Gen voraussetzt, würde zu den Lysergsäuren und den von ihr abgeleiteten einfachen Amiden und Peptiden führen. Auf Grund eines defekten cloA-Gens endet bei Claviceps fusiformis die Biosynthese auf der Stufe der Clavine.[16] Durch eine direkte Oxidation am C-8 von Agroclavin und Elymoclavin unter Beteiligung verschiedener Peroxidasen zu Setoclavin und Penniclavin nimmt die Vielfalt an Clavinen zu.
Eigenschaften
Clavine sind Bestandteil des toxischen Prinzips des Mutterkorns und der psychotropen Wirkung der rituell genutzten Windengewächsdrogen Ololiuqui (insbesondere aus Turbina corymbosa) und Tlitliltzin (Ipomoea violacea und andere Ipomoea-Arten). Clavine vermitteln ihre Effekte insbesondere über eine Wechselwirkung mit Dopamin- und Serotoninrezeptoren sowie α1-Adrenozeptoren. An diesen Rezeptoren können sie als mittelpotente bis potente Antagonisten oder Partialagonisten wirken.[17]
Verwendung
Clavinalkaloide selbst finden keine praktische Verwendung. Einige partialsynthetische Derivate von Mutterkornalkaloiden, die formal als Clavine angesehen werden können, finden in der Heilkunde Anwendung. So wird das Dihydrolysergol-Derivat Nicergolin zur Behandlung der senilen Demenz eingesetzt. Pergolid, ein vom Dihydrolysergol abgeleiteter Thioether, wurde in der Therapie der Parkinson-Krankheit verwendet. Einen Einsatz in der Tierheilkunde findet Metergolin, ein Carbamat des Dihydrolysergamins.
Einzelnachweise
- Schardl CL, Young CA, Hesse U et al.: Plant-symbiotic fungi as chemical engineers: multi-genome analysis of the clavicipitaceae reveals dynamics of alkaloid loci. In: PLoS Genet. 9, Nr. 2, 2013, S. e1003323. doi:10.1371/journal.pgen.1003323. PMID 23468653.
- Eckart Eich: Tryptophan-derived Alkaloids. In: Solanaceae and convolvulaceae – secondary metabolites: biosynthesis, chemotaxonomy, biological and economic significance. Springer, 2008, ISBN 3540745408, S. 213–260.
- Steiner U, Leibner S, Schardl CL, Leuchtmann A, Leistner E: Periglandula, a new fungal genus within the Clavicipitaceae and its association with Convolvulaceae. In: Mycologia. 103, Nr. 5, 2011, S. 1133–1145. doi:10.3852/11-031. PMID 21558502.
- Anatoly G. Kozlovsky: Producers of ergot alkaloids out of the Claviceps genus. In: Vladimir Kren, Ladislav Cvak (Hrsg.): Ergot: The Genus Claviceps. Medicinal and Aromatic Plants – Industrial Profiles. CRC Press, 2004, ISBN 0203304195, S. 479–499.
- Abe M, Yamatodan S: On a New Water-Soluble Ergot Alkaloid, Molliclavine. In: Bull. Agr. Chem. Soc. 192, 1955, S. 161–162.
- Vining LC, Mclnnes AG, Smith DG, Wright JL Taber WA: Dimeric clavine alkaloids produced by Penicillium citreo-viride. In: FEMS Symp. 13, 1982, S. 243–251.
- Martin Buchta, Ladislav Cvak: Ergot alkaloids and other metabolites of the genus Claviceps. In: Vladimir Kren, Ladislav Cvak (Hrsg.): Ergot: The Genus Claviceps. Medicinal and Aromatic Plants – Industrial Profiles. CRC Press, 2004, ISBN 0203304195, S. 173–201.
- Wallwey C, Li SM: Ergot alkaloids: structure diversity, biosynthetic gene clusters and functional proof of biosynthetic genes. In: Nat Prod Rep. 28, Nr. 3, 2011, S. 496–510. doi:10.1039/c0np00060d. PMID 21186384.
- King GS, Waight ES, Mantle PG, Szczyrbak CA: The structure of clavicipitic acid, an azepinoindole derivative from Claviceps fusiformis. In: J. Chem. Soc., Perkin Trans. 1, 1977, S. 2099–2103. doi:10.1039/P19770002099.
- Kozlovskiĭ AG, Solov'eva TF, Sakharovskiĭ VG, Adanin VM: [Biosynthesis of "unusual" ergot alkaloids by the fungus Penicillium aurantio-virens]. In: Dokl Akad Nauk SSSR. Nr. 1, S. 230–233. PMID 7307906.
- Tscherter H, Hauth H: Drei neue Mutterkornalkaloide aus saprophytischen Kulturen von Claviceps paspali Stevens et Hall. 77. Mitteilung über Mutterkornalkaloide. In: Helvetica Chimica Acta. 57, Nr. 1, 1974, S. 113–121. doi:10.1002/hlca.19740570111.
- Holzapfel CW: The Isolation and structure of cyclopiazonic acid, a toxic metabolite of Penicillium cyclopium Westling. In: Tetrahedron. 24 pages=2101–2119, 1968.
- Tudzynski P, Hölter K, Correia T, Arntz C, Grammel N, Keller U: Evidence for an ergot alkaloid gene cluster in Claviceps purpurea. In: Mol Gen Genet. 261, Nr. 1, 1999, S. 133–141. PMID 10071219.
- Panaccione DG: Origins and significance of ergot alkaloid diversity in fungi. In: FEMS Microbiol Lett. 251, Nr. 1, 2005, S. 9–17. PMID 16112823.
- Cheng JZ, Coyle CM, Panaccione DG, O'Connor SE: Controlling a structural branch point in ergot alkaloid biosynthesis. In: J Am Chem Soc. 132, Nr. 37, 2010, S. 12835–12837. doi:10.1021/ja105785p. PMID 20735127.
- Lorenz N, Wilson EV, Machado C, Schardl CL, Tudzynski P: Comparison of ergot alkaloid biosynthesis gene clusters in Claviceps species indicates loss of late pathway steps in evolution of C. fusiformis. In: Appl Environ Microbiol. 73, Nr. 22, 2007, S. 7185–2191. PMID 17720822.
- Heinz Pertz, Eckart Eich: Ergot alkaloids and their derivatives as ligands for serotoninergic, dopaminergic, and adrenergic receptors. In: Vladimir Kren, Ladislav Cvak (Hrsg.): Ergot: The Genus Claviceps. Medicinal and Aromatic Plants – Industrial Profiles. CRC Press, 2004, ISBN 0203304195, S. 411–440.