Muscimol
Muscimol ist ein psychotropes Alkaloid, das seine Wirkung über die Aktivierung von GABA-Rezeptoren entfaltet. Es entsteht durch Decarboxylierung von Ibotensäure, die in Pilzen der Gattung Amanita vorkommt.

| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
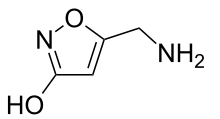 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Muscimol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H6N2O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 114,10 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
4,8 und 8,4[2] | |||||||||||||||||||||
| Löslichkeit |
leicht in Wasser (567 g·l−1)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Allgemeines
Muscimol wurde in der ersten Hälfte der 1960er-Jahre von mehreren Forschergruppen unabhängig voneinander im Zuge analytischer Arbeiten über die Inhaltsstoffe der Amanita-Pilze entdeckt und isoliert.[4][5] Seine Molekularstruktur wurde alsbald aufgeklärt und durch Synthese bestätigt.[6]
Bildung
Ibotensäure ist der im Fliegenpilz, Pantherpilz und Königsfliegenpilz enthaltene Ausgangsstoff, aus dem sich Muscimol durch Decarboxylierung unter bestimmten Bedingungen bildet, z. B. bei längerer Lagerung des Pilzes oder Trocknung bei etwa 60 °C. Es ist besser verträglich als sein Ausgangsstoff und seine halluzinogenen Wirkungen sind deutlich stärker.
Wirkung
Etwa zwei Stunden nach Einnahme kommt es bei Überdosierung zu Steigerung der Salivation, Ataxie, Psychosen und schließlich zum Kreislaufversagen. Weil die in Pilzen enthaltene Menge an Muscimol stark variiert, ist nicht vorauszuberechnen, ob ein Pilzgericht eine letale Dosis enthält. Todesfälle sind selten und betreffen vorwiegend Kleinkinder, ältere Personen und chronisch Kranke.[7]
Pharmakologie
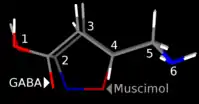
Muscimol ist ein Strukturanalogon der Gamma-Aminobuttersäure (GABA) und als solches ein hochaffiner, kompetitiver, orthosterischer Agonist (d. h. Ligand an der GABA-Bindungsstelle) an GABAA- und Partialagonist an GABAA-Rho-Rezeptoren.[8] An der Vielzahl von GABAA-Rezeptortypen wirkt Muscimol, entgegen der ursprünglichen Erwartung, nicht als unterschiedsloser Universalagonist.[9] An extrasynaptischen GABAA-Rezeptoren zeigt es mit einer auf GABA bezogenen maximalen Wirkstärke von 120 bis 140 % eine superagonistische Eigenschaft, welche erklärt wird mit der geringeren Neigung des Muscimols die Desensibilisierung dieser Rezeptoren auszulösen.[2] Mit geringer Affinität werden G-Protein-gekoppelte GABAB-Rezeptoren aktiviert.[10] Muscimol ist kein Substrat der GABA-Transaminase. Im Ergebnis aktiviert Muscimol das inhibitorische (zentral dämpfende) System des Gehirns.
In der extrazellulär gelegenen Bindungskavität zwischen den Untereinheiten α1− und β2+ des GABAA-Ionenkanals wird Muscimol über Salzbrücken und Wasserstoffbrückenbindungen gebunden, und zwar über die Aminosäurereste Arg66, Thr129, Thr202 einerseits und Glu155 andererseits, wobei zusätzlich eine konzertierte Bindung über ein Wassermolekül mit den Rückgrat-Carbonylgruppen von Ser156 und Tyr157 möglich ist. Kation–Pi-Wechselwirkungen ergeben sich über die ionisierte Aminfunktion des Liganden mit den rezeptorseitigen Aromaten Tyr205 und Phe200.[11]
Bei Sondierungen der Struktur-Wirkungsbeziehungen an GABAA-Rezeptoren zeigte sich unter den strukturell enger verwandten Derivaten bislang nur (S)-4,5-Dihydromuscimol als etwas höher affin.[11][12]
Weiterhin führt Muscimol zu einem Anstieg der Konzentration an Serotonin im synaptischen Spalt der Nervenzellen des zentralen Nervensystems.[13]
Chemie
Für die präparative Synthese existieren verschiedene Zugänge.[5] Möglich ist sie ausgehend von γ-Chloracetoacetat, das erhalten werden kann durch Chlorierung von Acetessigester bzw. Diketen. Die Ketofunktion des γ-Chloracetoacetats wird mit Orthoformiat zum Ketal geschützt. Mit Hydroxylamin wird der Ester unter schonenden Bedingungen zur Hydroxamsäure umfunktionalisiert. Mit chlorwasserstoffgesättigter Essigsäure wird das Ketal entschützt und in situ der Ringschluss zum 3-Hydroxy-5-chlormethyl-isoxazol vollzogen. Dieses Zwischenprodukt wird durch Kochen in ammoniakalischer Lösung unter Austausch des Chlor-Nukleofugs aminiert und so schließlich das Titelprodukt erhalten.[6]
Einzelnachweise
- Eintrag zu Muscimol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- G. A. Johnston: Muscimol as an ionotropic GABA receptor agonist. In: Neurochemical research. Band 39, Nummer 10, Oktober 2014, S. 1942–1947, doi:10.1007/s11064-014-1245-y, PMID 24473816.
- Eintrag zu Muscimol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- G. F. Müller, C. H. Eugster: [Muscimol, a Pharmacodynamically Active Substance From Amanita Muscaria]. In: Helvetica chimica acta. Band 48, Juni 1965, S. 910–926, doi:10.1002/hlca.19650480427, PMID 14321963.
- P. Pevarello, M. Varasi: An Improved Synthesis of Muscimol. In: Synthetic Communications. 22, Nr. 13, 1992, S. 1939. doi:10.1080/00397919208021324. Referenzen dort.
- A.R. Gagneux, F. Häfliger, C.H. Eugster, R. Good: Synthesis of pantherine (agarin). In: Tetrahedron Letters. 6, Nr. 25, 1965, S. 2077. doi:10.1016/S0040-4039(00)90157-6.
- David G Spoerke; Barry H Rumack (Hrsg.): Handbook of mushroom poisoning: diagnosis and treatment, Boca Raton, Ann Arbor, London: CRC Press, 1994, S. 269, ISBN 9780849301940, Vorschau Google Books.
- R. M. Woodward, L. Polenzani, R. Miledi: Characterization of bicuculline/baclofen-insensitive (rho-like) gamma-aminobutyric acid receptors expressed in Xenopus oocytes. II. Pharmacology of gamma-aminobutyric acidA and gamma-aminobutyric acidB receptor agonists and antagonists. In: Molecular pharmacology. Band 43, Nummer 4, April 1993, S. 609–625, PMID 8386310.
- D. Chandra, L. M. Halonen, A. M. Linden, C. Procaccini, K. Hellsten, G. E. Homanics, E. R. Korpi: Prototypic GABA(A) receptor agonist muscimol acts preferentially through forebrain high-affinity binding sites. In: Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. Band 35, Nummer 4, März 2010, S. 999–1007, doi:10.1038/npp.2009.203, PMID 20032968, PMC 2823376 (freier Volltext).
- T. Yamauchi, T. Hori, T. Takahashi: Presynaptic inhibition by muscimol through GABAB receptors. In: The European journal of neuroscience. Band 12, Nummer 9, September 2000, S. 3433–3436, PMID 10998126.
- J. G. Petersen, R. Bergmann, P. Krogsgaard-Larsen, T. Balle, B. Frølund: Probing the orthosteric binding site of GABAA receptors with heterocyclic GABA carboxylic acid bioisosteres. In: Neurochemical research. Band 39, Nummer 6, Juni 2014, S. 1005–1015, doi:10.1007/s11064-013-1226-6, PMID 24362592 (Review).
- P. Krogsgaard-Larsen, L. Nielsen, E. Falch, D. R. Curtis: GABA agonists. Resolution, absolute stereochemistry, and enantioselectivity of (S)-(+)- and (R)-(-)-dihydromuscimol. In: Journal of medicinal chemistry. Band 28, Nummer 11, November 1985, S. 1612–1617, PMID 2999396.
- Emsbach: Gefahrstoffe – Pflanzenschutz – Umweltschutz, Deutscher Apotheker Verlag, Stuttgart 2008. ISBN 978-3-7692-4309-3.
