Bicucullin
Bicucullin ist ein Alkaloid und ein potenter, selektiver und kompetitiver GABAA-Rezeptor-Antagonist.[5]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
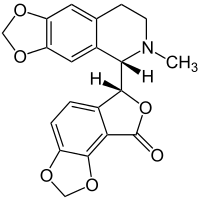 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Bicucullin | |||||||||||||||||||||
| Andere Namen |
(6R)- 6- [(5S)- 6-Methyl- 5, 6, 7, 8- tetrahydro [1,3]dioxolo [4,5-g] isochinolin- 5- yl] furo[3,4-e] [1,3] benzodioxol- 8(6H)- on (IUPAC) | |||||||||||||||||||||
| Summenformel | C20H17NO6 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis gelbliches Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 367,35 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Löslichkeit |
Löslich in Ethanol zu 5 mM und in DMSO zu 100 mM[3], außerdem in Benzol, Chloroform und Essigsäureethylester[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen

Die schwach gelbliche, lichtempfindliche Substanz wurde erstmals 1932 in einem Extrakt aus der namensgebenden Kapuzen-Herzblume (Dicentra cucullaria) gefunden.[6] Sie kommt außer dort auch in anderen Arten der Herzblumen vor[7] sowie in den ebenfalls zu den Erdrauchgewächsen gehörenden Lerchenspornen.[8]
Wirkung
Bicucullin blockiert GABAA-Rezeptoren. Diese Rezeptoren sind Ionenkanäle, die Ionen, in diesem Fall negativ geladenes Chlorid, ins Zellinnere passieren lassen. Der Transport negativer Ladung ins Zellinnere hyperpolarisiert Nervenzellen und macht sie weniger erregbar. Blockade der Kanäle blockiert die Inhibition und wirkt somit erregend und konvulsiv auf das Nervensystem. Die Symptome einer Bicucullinvergiftung ähneln denen der Epilepsie.
Als GABA-Antagonist ähnelt Bicucullin dem Pflanzengift Picrotoxin der Scheinmyrte und dem synthetischen Wirkstoff Gabazin. Wichtige GABA-Agonisten sind Muscimol, eines der Gifte des Fliegenpilzes, und der Wirkstoff Baclofen.[9][10][11]
Anwendungen
Bicucullin wird in der Grundlagenforschung angewendet, so im Laborversuch zum Studium der Epilepsie in vivo[12] und zur Blockade von GABAA-Rezeptoren in vitro.
Neben seiner selektiven Wirkung auf GABAA-Rezeptor-Kanäle blockiert es außerdem Ca2+-aktivierte Kalium-Kanäle,[13] und unterdrückt das Wachstum von Pilzsporen.[8]
Pharmakologisch auf den GABAA-Rezeptor wirksame Konzentrationen von Bicucullin liegen bei wenigen μM. Da Bicucullin ausgesprochen schlecht wasserlöslich ist, wird es oft in DMSO appliziert.
GABAA-Rezeptoren sind Hauptziel der Benzodiazepine und verwandter anxiolytischer Pharmazeutika. Bicucullin kann in seiner Rolle als GABAA-Rezeptor-Antagonist die Wirkung dieser Substanzen aufheben.[14]
Einzelnachweise
- Datenblatt (+)-Bicuculline bei Enzo Life Sciences, abgerufen am 3. Dezember 2014.
- Datenblatt (+)-Bicuculline bei Sigma-Aldrich, abgerufen am 22. Oktober 2016 (PDF).
- Abcam: Bicuculline, abgerufen am 4. Oktober 2014.
- Tocris: Bicuculline, abgerufen am 4. Oktober 2014.
- K. Starke: Grundlagen der Pharmakologie des Nervensystems. In: K. Aktories, U. Förstermann, F. Hofmann und K. Starke (Hrsg.): Allgemeine und spezielle Pharmakologie und Toxikologie. 11. Auflage, München, Elsevier GmbH 2013, S. 95–125, hier S. 115–116. ISBN 978-3-437-42523-3.
- Manske, R. H. F.: The Alkaloids of Fumaraceous Plants. II. Dicentra cucullaria (L.) Bernh.. In: Canadian Journal of Research. 7, 1932, S. 265–269. doi:10.1139/cjr32-078.
- Israilov, I.A., Melikov F. M., Murav'eva D.A.: Alkaloids of Dicentra. In: Chemistry of Natural Compounds. 20, 1984, S. 74–76. doi:10.1007/BF00574796.
- Basha S. A., Mishra R.K., Jha R.N., Pandey V.B., Singh U.P.: Effect of berberine and (±)-bicuculline isolated from Corydalis chaerophylla on spore germination of some fungi. In: Folia Microbiologica. 47, 2002, S. 161–165. doi:10.1007/BF02817675.
- W. Bautista, J. Aguilar, J. E. Loeza-Alcocer, R. Delgado-Lezama: Pre- and postsynaptic modulation of monosynaptic reflex by GABAA receptors on turtle spinal cord. In: The Journal of physiology. Band 588, Pt 14 Juli 2010, S. 2621–2631, doi:10.1113/jphysiol.2010.188979, PMID 20519320, PMC 2916992 (freier Volltext).
- Makoto Taketani: Advances in Network Electrophysiology. Springer Science & Business Media, 2006, ISBN 978-0-387-25858-4, S. 305f (eingeschränkte Vorschau in der Google-Buchsuche).
- B. H. Liu, G. K. Wu, R. Arbuckle, H. W. Tao, L. I. Zhang: Defining cortical frequency tuning with recurrent excitatory circuitry. In: Nature Neuroscience. Band 10, Nummer 12, Dezember 2007, S. 1594–1600, doi:10.1038/nn2012, PMID 17994013, PMC 2447868 (freier Volltext).
- Söderfeldt B., Kalimo H., Olsson Y., Siesjö B. K.: Bicuculline-induced epileptic brain injury. In: Acta Neuropathologica. 62, 1983, S. 87–95. doi:10.1007/BF00684924.
- R. Khawaled, A. Bruening-Wright, J. P. Adelman, J. Maylie: Bicuculline block of small-conductance calcium-activated potassium channels. In: Pflügers Archiv – European Journal of Physiology. Band 438, Nummer 3, August 1999, S. 314–321, PMID 10398861.
- H. Dickinson-Anson, M. H. Mesches, K. Coleman, J. L. McGaugh: Bicuculline administered into the amygdala blocks benzodiazepine-induced amnesia. In: Behavioral and neural biology. Band 60, Nummer 1, Juli 1993, S. 1–4, PMID 8216155.