Morpholin
Morpholin ist eine heterocyclische, bei Raumtemperatur flüssige organische Verbindung mit der Summenformel C4H9NO. Der gesättigte Sechsring enthält sowohl eine Ether-Gruppe als auch eine sekundäre Amin-Gruppe; nach dem Hantzsch-Widman-System ist es somit ein hydriertes (und daher gesättigtes) Oxazin bzw. ein Oxazinan.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Morpholin (IUPAC) | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H9NO | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit ammoniakartigem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 87,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,00 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
129 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
8,36[2] | |||||||||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser[1] | |||||||||||||||||||||
| Brechungsindex |
1,454 (20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Gewinnung und Darstellung
Zur großtechnischen Herstellung von Morpholin setzt man Diethylenglycol mit Ammoniak bei Temperaturen von 130–240 °C und Drücken von 150–240 bar in Gegenwart von Nickel-, Kupfer- und Cobaltoxid-Katalysatoren, welche auf Aluminiumoxid (Al2O3) geträgert sind, um.[8]
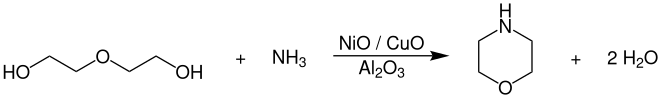
Die komplette Reaktion verläuft dabei in der flüssigen Phase in einem kontinuierlichen Rohr- oder Rohrbündelreaktor. Der Katalysator wird als Festbett angeordnet und die Umsetzung bevorzugt in der Rieselfahrweise durchgeführt. Die Reinigung und Aufarbeitung des Produkts erfolgt durch mehrstufige Destillation in Rektifikationskolonnen.[8]
Außerdem kann Morpholin aus Diethanolamin[7] oder aus Bis(2-chlorethyl)ether gewonnen werden. Diese Verfahren haben allerdings keine großtechnische Bedeutung.[9]
Eigenschaften
Physikalische Eigenschaften
Morpholin ist eine brennbare, hygroskopische, farblose Flüssigkeit mit aminartigem Geruch.[7] Mit Wasser reagiert es leicht basisch. Der Siedepunkt bei Normaldruck liegt bei 128,95 °C.[10] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend ln(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 14,5733, B = 3384,26 und C = −61,453 im Temperaturbereich von 308 bis 393 K.[11]
Sicherheitstechnische Kenngrößen
Morpholin bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 31 °C.[1][12] Der Explosionsbereich liegt zwischen 1,8 Vol.‑% (64 g/m3) als untere Explosionsgrenze (UEG) und 15,2 Vol.‑% (550 g/m3) als obere Explosionsgrenze (OEG).[1][12] Die Grenzspaltweite wurde mit 0,92 mm bestimmt.[1][12] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[12] Die Zündtemperatur beträgt 275 °C.[1] Der Stoff fällt somit in die Temperaturklasse T3.
Sicherheitshinweise
Morpholin ist gesundheitsschädlich beim Einatmen, Verschlucken und Berührung mit der Haut. Es verursacht Verätzungen. Einatmen von Morpholin führt zu Lungenödemen und nachfolgenden Leber- und Nierenschäden. Mit nitrosierenden Verbindungen (z. B. Nitriten, Stickoxiden) können sich Nitrosamine bilden, welche krebserregend wirken können.
Morpholin hat eine LD50 von 500 mg·kg−1 (dermal, Kaninchen), sowie 1910 mg·kg−1 (oral, Ratte).
Verwendung
- Zusatz zu Wasser- und Dampfsystemen als Korrosionsinhibitor und zur Anpassung des pH-Wertes[7]
- Herstellung von Vulkanisationshilfsmitteln für die Kautschuk- und Gummiindustrie
- Zusatz bei der Betonverarbeitung
- Zusatz zu Wachsen, die zur Behandlung der Oberflächen von frischem Obst angewendet werden. Diese Verwendung ist in den EU-Staaten nicht zugelassen, aber z. B. in den USA, Kanada und Südamerika.[13]
- Herstellung der Arzneistoffe Bufexamac, Dextromoramid, Doxapram, Emorfazon, Fenclofenac, Folescutol, Fomocain, Molindon, Moracizin, Morinamid, Naproxen, Sulmetocin, Timolol und Trimetotin[14] sowie dem PI3K-Inhibitor GDC-0941[15]
- In der organischen Synthese als schwache Aminbase[7]
- Speziell zur Synthese von Phenylessigsäurederivaten nach dem Willgerodt-Kindler-Verfahren
- Eine Klasse von Fungiziden (Aldimorph, Dodemorph, Fenpropimorph, Tridemorph) hat Morpholin als gemeinsames Strukturmotiv[16]
Einzelnachweise
- Eintrag zu Morpholin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Oktober 2019. (JavaScript erforderlich)
- The Evans Group: pKa's of Nitrogen Acids. (PDF) In: Chemistry and Chemical Biology. Harvard University, 4. November 2005, abgerufen am 23. August 2019.
- Datenblatt Morpholine bei Sigma-Aldrich, abgerufen am 11. April 2011 (PDF).
- Eintrag zu Morpholine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte, abgerufen am 20. August 2019.
- Datenblatt Morpholin (PDF) bei Merck, abgerufen am 27. Februar 2010.
- Eintrag zu Morpholin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Mai 2020.
- Patent WO2007036496: Verfahren zur Herstellung von Aminodiglykol (ADG) und Morpholin. Veröffentlicht am 5. April 2007, Anmelder: BASF AG, Erfinder: Bram Willem Hoffer, Holger Evers, Petr Kubanek, Till Gerlach, Johann-Peter Melder, Frank Funke, Matthias Frauenkron, Helmut Schmidtke.
- Siegfried Hauptmann: Organische Chemie, Verlag Harry Deutsch, Thun 1985, ISBN 3-87144-902-4, S. 602.
- Sovova, M.; Boublik, T.: Liquid-vapor equilibrium. Part C. Vapor-liquid equilibrium in the water(1)-morpholine(2) system at the pressures of 50 and 75 kPa in Collect. Czech. Chem. Commun. 51 (1986) 1899.
- Ming-Jer Lee, Chang-Ching Su, Ho-mu Lin: Vapor Pressures of Morpholine, Diethyl Methylmalonate, and Five Glycol Ethers at Temperatures up to 473.15 K in J. Chem. Eng. Data 50 (2005) 1535–1538, doi:10.1021/je049627d.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Europäisches Parlament: Betrifft: Einfuhrverbot für chilenische Äpfel, Parlamentarische Anfrage des Abgeordneten Filip Kaczmarek vom 24. Januar 2011.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dieter Reichert: Pharmaceutical Substances, 4. Auflage (2000) 2 Bände erschienen im Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- Paul Workman, Paul A. Clarke, Florence I. Raynaud, Rob L. M. van Montfort: Drugging the PI3 Kinome: From Chemical Tools to Drugs in the Clinic. In: Cancer Research. Band 70, Nr. 6, 15. März 2010, S. 2146–2157, doi:10.1158/0008-5472.CAN-09-4355.
- Clemens Lamberth: Bioactive Heterocyclic Compound Classes. Hrsg.: Clemens Lamberth, Jürgen Dinges. Wiley-VCH, 2012, ISBN 978-3-527-66441-2, Morpholine Fungicides for the Treatment of Powdery Mildew, S. 119–127, doi:10.1002/9783527664412.ch10.


