Creatin-Kinase
Die Creatin-Kinase (auch als CK, CPK, Creatin-Phosphokinase oder als Kreatinkinase bezeichnet) ist ein Enzym, das eine N-Phosphoryl-Gruppe von Phospho-Kreatin auf Adenosindiphosphat (ADP) überträgt (Phosphorylierung ist kennzeichnend für Kinasen). Mit dieser enzymatischen Reaktion wird Adenosintriphosphat (ATP), die universelle Energiequelle in allen Zellen, regeneriert. Das Enzym kommt vor allem in allen Muskelzellen und im Gehirn, aber auch in den Hoden, Nieren, Retina und Spermien etc. vor. Es werden vier Isoenzyme unterschieden:
- CK-MM (Skelettmuskeltyp),
- CK-MB (Myokardtyp),
- CK-BB (Gehirntyp) und
- CK-MiMi oder mt-CK (Mitochondrientyp).[2][3]
| Creatin-Kinase | ||
|---|---|---|
| ||
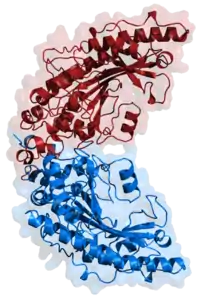
| Modell der Gehirntyp-Kreatinkinase (CK-BB-Isozym) des Haushuhns (Gallus gallus domesticus), aus PDB 1qh4.[1] Die Röntgenstruktur der Hühner-BB-CK ist die bis dato mit höchster Auflösung (1,41 Å) bestimmte molekulare Struktur eines Mitgliedes der Familie der sogenannten Phosphagenkinasen. Das Dimer erinnert an die Form einer Banane. | ||
|
Vorhandene Strukturdaten: 1QH4 1CRK 1G0W 1VRP 1U6R 2CRK 2GL6 3B6R 3DRB | ||
| Masse/Länge Primärstruktur | 380 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer, Heterodimer | |
| Isoformen | BB, MB, MM | |
| Bezeichner | ||
| Gen-Name(n) | CKB, CKM Creatin-Kinase | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.3.2, Kinase | |
| Reaktionsart | Phosphorylierung | |
| Substrat | Kreatin | |
| Produkte | Phosphokreatin | |
| Vorkommen | ||
| Homologie-Familie | Guanidokinase | |
| Übergeordnetes Taxon | Lebewesen | |
Häufig wird das Enzym auch als Kreatinin-Kinase bezeichnet. Kreatinin ist allerdings nur das im Urin enthaltene Abbauprodukt des Kreatins.
Physiologische Bedeutung
ATP hat in Organismen vor allem als Energieträger, aber auch als Signalmolekül, eine herausragende Bedeutung. ATP kann sowohl durch Substratkettenphosphorylierung als auch durch Elektronentransportphosphorylierung (Atmungskette) aus ADP gewonnen werden. Allerdings wird in vielen Geweben mit hohem Energiebedarf, beispielsweise in Skelettmuskeln, Energie nicht ausschließlich in Form von ATP vorgehalten, da die dafür erforderlichen hohen ATP-Konzentrationen ATP-abhängige Stoffwechselprozesse der Zellen stören würden. Stattdessen liegen hohe Konzentrationen des Phosphagens Phosphokreatin vor, dessen Gruppenübertragungspotenzial so hoch ist, dass es ADP zu ATP phosphorylieren kann. Bei kurzfristig hohem Energiebedarf kann ATP durch diese Reaktion, die durch die Creatin-Kinase katalysiert wird, schneller gewonnen werden als durch oxidative Phosphorylierung. Das Creatin-Kinase/Phosphokreatin-System wirkt somit als kurzzeitiger Energiepuffer. Des Weiteren wird durch die Phosphorylierung von ADP zu ATP die intrazelluläre ADP- und Protonenkonzentration verringert, was einer Inaktivierung zellulärer ATPasen und Versauerung des Cytosols bei hohem Energiebedarf entgegenwirkt. Durch eine Lokalisation von Creatin-Kinasen an Orten hoher ATPase-Aktivität wird darüber hinaus das lokale ATP/ADP-Verhältnis erhöht, um die thermodynamische Effizienz der ATP-Hydrolyse zu steigern.[2][4]
Des Weiteren dient das Creatin-Kinase/Phosphokreatin-System nicht nur als Energiepuffer, sondern auch zum Energietransport. In den Mitochondrien, einem Kompartiment mit vergleichsweise hohen ATP-Konzentrationen, wird durch die mitochondriale Isoform der Creatin-Kinase unter ATP-Verbrauch Kreatin phosphoryliert. Das dabei produzierte Phosphokreatin diffundiert dann an Orte mit hohem Energiebedarf, wo es durch andere Isoformen der Creatin-Kinase unter ATP-Produktion wieder in Kreatin umgewandelt wird.[4]
Atomare Struktur der zytosolischen und mitochondrialen Creatine-Kinase(CK)-Isoenzyme
Die hochauflösenden Strukturen verschiedener Creatin-Kinase (CK) Isoformen konnten in einer Kooperation der beiden Forschungsgruppen von Theo Wallimann an der ETH Zürich und von Wolfgang Kabsch am Max-Planck-Institut für medizinische Forschung in Heidelberg auf atomarem Niveau gelöst werden. Die erste atomare Struktur einer Creatin-Kinase, die mittels Röntgenstruktur-Analyse von kristallisierten CK gelöst werden konnten, war die sarcomerische (Muskel-Typ) mitochondriale CK (s-mtCK) 1996,[5] gefolgt von der ubiquitären mitochondrialen CK (u-mtCK) 2000.[6] Im Kristall bilden beide mitochondrialen CK-Isoformen oktamere Strukturen mit 4-facher Symmetrie.[7][8][9] Die atomare Struktur der bananenförmigen, dimeren, zytosolischen Hirn-Typ (brain-type) BB-CK konnte im Jahre 1999 mit einer Auflösung von 1,4 Å gelöst werden.[1] Jedes CK-Monomer im Dimer enthält ein eigenes enzymatisch aktives Zentrum.[10]
Creatin-Kinase in der Diagnostik
Die Gesamt-CK ist die Summe der vier Isoenzyme (s. o.). Weil die Gesamt-CK meist N-Acetylcystein-stabilisiert gemessen wird, wird für Angaben der Gesamt-CK-Aktivität oft die Abkürzung CK-NAC verwendet. Die Messung der CK-MB-Aktivität erfolgt routinemäßig mittels Immuninhibitions-Test. Die Differenzierung der übrigen CK-Isoenzyme erfolgt mittels Elektrophorese. Die Isoenzym-Elektrophorese kann auch zum Nachweis der Makro-CK eingesetzt werden, die bei der Immuninhibition zu unplausiblen Werten führen kann.[11]
Eine Erhöhung der CK-Aktivität im Blut deutet auf eine Herz- oder Skelettmuskelerkrankung hin, bei der Muskelzellen geschädigt wurden. Die CK ist damit ein wichtiges Enzym für die Diagnose von jenen Schädigungen der Herz- und Skelettmuskulatur, die mit einem Anstieg der CK einhergehen. Die Höhe eines CK-Anstiegs und die Infarktgröße korrelieren miteinander. Da man aus der Aktivität der CK schwer zwischen Herz- und anderen Muskelzerstörungen unterscheiden kann, wird immer häufiger das Troponin zur Herzinfarktdiagnostik benutzt. Ist der Wert der CK-MB größer als 6 Prozent der Gesamt-CK, geht man von einem Myocardschaden aus. Bevor die Möglichkeit zur Bestimmung des Troponins bestand, galt eine CK-MB-Erhöhung > 10 % zusammen mit einem charakteristischen EKG-Befund oder charakteristischen Beschwerden als sicherer Infarktnachweis.

Labordiagnostik
In der Labordiagnostik wird die CK-Aktivität aus dem Plasma oder dem Serum bei Verdacht auf Herz- oder Skelettmuskelerkrankungen bestimmt. Die Messung der CK-Aktivität im Rahmen der Herzinfarktdiagnostik ist heute jedoch nicht mehr notwendig, da bessere Tests wie Troponin T/I oder CK-MB-Masse (= CK-MB-Konzentration)[12] verfügbar sind.
Referenzbereich für Messungen bei 37 °C nach IFCC (U = Enzymeinheit, angegeben pro Liter (l))
- Frauen: <145 U/l,
- Männer: <170 U/l.
Kinder:
- 0d – 1d: < 712 U/l
- 2d – 5d: < 652 U/l
- 6d – 6m: < 295 U/l
- 7m – 11m: < 203 U/l
- 1a – 3a: < 228 U/l
- 4a – 6a: < 149 U/l
- 7a – 12a:
- weibl.: < 154 U/l
- männl.: < 247 U/l
- 13a – 17a:
- weibl.: < 123 U/l
- männl.: < 270 U/l
Bei allgemeinen Muskelerkrankungen, wie der Progressiven Muskeldystrophie, Post-Polio-Syndrom oder Myositis, ist die CK-Aktivität auf über 25000 U/l stark erhöht. Bei einem Herzinfarkt liegt die CK-Aktivität meistens unter 7500 U/l.
Bei intensivem, exzentrischem (negativ, nachgebend) Krafttraining, EMS-Training und im Spitzen-Ausdauersportbereich werden des Öfteren Werte in Bereichen von 20000 bis 45000 gemessen, zumeist zwei oder drei Tage nach der Belastung. Ein erhöhter Wert kann also auch auf ein vorhergehendes Training zurückzuführen sein, wobei bereits ein Wert über 10000 U/l zu Nierenversagen führen kann.
Gerade Krafttrainingsübungen wie z. B. tiefe Kniebeugen, Kreuzheben und Klimmzüge oder Ruderbewegungen und Ausdauersportarten, welche die großen Muskeln hochintensiv belasten, erhöhen die CK-Werte schnell auf Werte jenseits der 1000 U/l.
Nach Operationen, Injektionen (intramuskulär) und Verletzungen, bei denen Muskelzellen betroffen sind, steigt die CK-Aktivität ebenfalls an. Hier ist die Aktivität abhängig von der Größe der Verletzung.
Auch Medikamente wie Statine und Fibrate können die CK-Konzentration im Blut beeinflussen.
Siehe auch
Einzelnachweise
- M. Eder, U. Schlattner, A. Becker, T. Wallimann, W. Kabsch, K. Fritz-Wolf: Crystal structure of brain-type creatine kinase at 1.41 A resolution. In: Protein science : a publication of the Protein Society. Band 8, Nummer 11, November 1999, S. 2258–2269, doi:10.1110/ps.8.11.2258, PMID 10595529, PMC 2144193 (freier Volltext).
- U. Schlattner, M. Tokarska-Schlattner, T. Wallimann: Mitochondrial creatine kinase in human health and disease. In: Biochim. Biophys. Acta. 1762, Nr. 2, Februar 2006, S. 164–180. doi:10.1016/j.bbadis.2005.09.004. PMID 16236486.
- T. Wallimann u. a.: The Phosphocreatine Circuit: Molecular and Cellular Physiology of Creatine Kinases, Sensitivity to Free Radicals, and Enhancement by Creatine Supplementation. In: Valdur Saks (Hrsg.): Molecular System Bioenegetics. Wiley 2007, ISBN 978-3-527-31787-5.
- T. Wallimann, M. Wyss, D. Brdiczka, K. Nicolay, H.M. Eppenberger: Intracellular compartmentation, structure and function of creatine kinase isoenzymes in tissues with high and fluctuating energy demands: The 'phosphocreatine circuit' for cellular energy homeostasis. In: The Biochemical Journal. 281 (Pt.1), 1992, S. 21–40. PMID 1731757. PMC 1130636 (freier Volltext).
- Fritz-Wolf et al. 1996 http://publicationslist.org/data/theo.wallimann/ref-135/Fritz-Wolf-sMtCK%20structure.pdf
- Eder et al. 2000 http://publicationslist.org/data/theo.wallimann/ref-101/Eder-X-ray.uMtCK.pdf
- Schnyder et al. 1990 http://publicationslist.org/data/theo.wallimann/ref-184/Schnyder%201990%20Crystallization%20and%20preliminary%20X-ray%20of%20MtCk%20J%20Mol%20Biol.pdf
- Schnyder et al. 1991 http://publicationslist.org/data/theo.wallimann/ref-180/SchnyderT_Gross-MtCK-crystal-EMs.pdf
- Eder et al. 2000 http://publicationslist.org/data/theo.wallimann/ref-101/Eder-X-ray.uMtCK.pdf
- Hornemann et al. 2000 http://publicationslist.org/data/theo.wallimann/ref-96/Hornmann-CK-dimer.pdf
- Lothar Thomas: Labor und Diagnose 2020 | Kapitel 01: Enzyme. Abgerufen am 23. November 2020 (deutsch).
- CK-MB-Masse, Synonym CK-MB-Konzentration. (Nicht mehr online verfügbar.) In: Klinische Chemie, Präanalytik, Untersuchungen (Leistungsverzeichnis). Universitätsklinikum Ulm, 10. September 2013, archiviert vom Original am 2. April 2015; abgerufen am 1. April 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
Literatur
- Neumeister, Besenthal, Liebrich: Klinikleitfaden Labordiagnostik. Urban&Fischer, München/ Jena, 2003, ISBN 3-437-22231-7.
- Lothar Thomas: Labor und Diagnose. TH-Books, Frankfurt am Main 2005, ISBN 3-9805215-5-9.
- T. Wallimann, M. Wyss, D. Brdiczka, K. Nicolay, H. M. Eppenberger: Intracellular compartmentation, structure and function of creatine kinase isoenzymes in tissues with high and fluctuating energy demands: the 'phosphocreatine circuit' for cellular energy homeostasis. In: Biochem. J.. 281 (Pt 1), Januar 1992, S. 21–40. PMID 1731757. PMC 1130636 (freier Volltext).
- G. Schumann, R. Bonora, F. Ceriotti u. a.: IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37 degrees C. Part 2. Reference procedure for the measurement of catalytic concentration of creatine kinase. In: Clin. Chem. Lab. Med.. 40, Nr. 6, Juni 2002, S. 635–642. doi:10.1515/CCLM.2002.110. PMID 12211662.
- T. Wallimann, M. Tokarska-Schlattner, U. Schlattner: The creatine kinase system and pleiotropic effects of creatine. In: Amino Acids. 40, Nr. 5, Mai 2011, S. 1271–1296, doi:10.1007/s00726-011-0877-3.
- F. R. Clara: Die Hypothyreose als Ursache für die CPK-MM Erhöhung bei Herzpatienten. In: Schweiz. Med. Wchschr. Dezember 1976.
- William Graham Wood, Udo Kramer: Re.: Correction to the IFCC primary reference method for the measurement of catalytic activity concentration of enzymes at 37C- part 2: reference procedure for the measurement of creatine kinase. In: Clinical Chemistry and Laboratory Medicine. Band 42, Nr. 3, 2004, S. 635–642, doi:10.1515/CCLM.2004.063.