Small interfering RNA
Small interfering RNA, abgekürzt siRNA, (eng. für kleine eingreifende RNA) sind kurze, einzel- oder doppelsträngige Ribonukleinsäure-Moleküle von 20 bis 25 Basenpaaren Länge. Sie codieren keine Proteine, sondern verbinden sich mit komplementären einzelsträngigen Ribonukleinsäure-Molekülen, wodurch sie deren normale Funktion unterbinden.
Dieser Vorgang wird RNA-Interferenz genannt und spielt eine wichtige Rolle in den Zellen von Lebewesen mit einem Zellkern, den Eukaryoten. So unterdrückt RNA-Interferenz die Expression von Genen und stoppt die Replikation von Viren.
Struktur
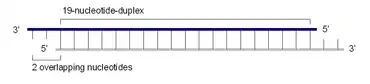
Eine siRNA ist ein etwa 19 bis 23 Basenpaare langer RNA-Doppelstrang, dessen Einzelstränge jeweils am 3'-Ende um zwei Nukleotide überhängen. Das 5'-Ende jedes Stranges ist phosphoryliert, während die 3'-Enden freie Hydroxygruppen tragen.
Biosynthese
Die siRNA wird durch eine Spaltung eines großen doppelsträngigen RNA-Moleküls gebildet. Diese Vorläufer-RNA kann mehrere Hunderte bis Tausende Basenpaare groß sein und fällt beispielsweise bei der Vervielfältigung viraler RNA an. An der Spaltung ist insbesondere das Enzym Dicer, eine sogenannte RNase vom Typ III, beteiligt.
Funktion
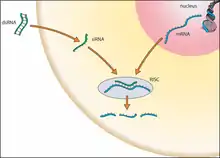
Die siRNA wird in vielen Zellen als eine Folge der Infektion mit einem RNA-Virus gebildet und spielt insbesondere bei Pflanzen bei der Verteidigung gegen fremde RNA eine wichtige Rolle. Sie fällt als ein Spaltprodukt bei der Vervielfältigung (Replikation) der Virus-RNA an und dient zugleich der Zelle zur Erkennung und Zerstörung dieser fremden RNA. Ähnliche Mechanismen konnten auch bei Pilzen, Fadenwürmern und Insekten gefunden werden. Zahlreiche Viren versuchen ihrerseits über eine Hemmung der an der RNA-Interferenz beteiligten Proteine diesem Abwehrmechanismus zu entgehen.[1]
Auch bei der Genregulation über das Posttranskriptionelle Gen-Silencing kann die siRNA eine zentrale Rolle spielen, indem sie die Selektivität bestimmt. Zusammen mit speziellen Proteinkomponenten bildet sie den RNA-induced silencing complex (RISC). Nur ein Strang der siRNA, der in diesem Zusammenhang ‚Leitstrang‘ genannt wird, wird dabei übernommen. Einzelsträngige RNA, insbesondere also Messenger-RNA, die die zum Leitstrang der siRNA komplementäre Nukleotidsequenz enthält, wird vom RISC zerstört oder die Translation zum Protein auf andere Weise verhindert. Da nur solche mRNA zum Protein übersetzt wird, die dem RISC entkommt, ist die Aktivität des betroffenen Gens reduziert. Erstes Opfer dürfte im Allgemeinen der nicht übernommene Teilstrang der siRNA sein.
Anwendung
siRNA wird insbesondere in der Grundlagenforschung zur Aufklärung der noch unbekannten Funktion eines zu untersuchenden bekannten Gens und dessen codierten Proteins mit Hilfe der RNA-Interferenz genutzt. Durch die gezielte Abschaltung des Gens mit Hilfe von siRNA kann die Funktion des von ihm codierten Proteins abgeleitet werden. Auch für die umgekehrte Fragestellung, die Suche nach den für eine bekannte Funktion oder ein bestimmtes Merkmal verantwortlichen Genen oder Proteinen, können siRNA-Bibliotheken genutzt werden.
Auch die therapeutische Anwendung von siRNA in der Medizin ist Gegenstand der Forschung. Vier siRNA-basierte Wirkstoffe wurden seit 2018 bereits zugelassen. Weitere siRNA-basierte potenzielle Arzneistoffe befinden sich in Erprobung.
- In 2018 wurde Patisiran als erstes siRNA basiertes Medikament zugelassen.
- 2020 folgten die Zulassungen von Givosiran,
- Lumasiran und
- Inclisiran.
Nach dem Scheitern von Bevasiranib[2] stellten mehrere große pharmazeutische Unternehmen, darunter auch Merck & Co., Novartis und Roche, ihre auf siRNA basierenden Entwicklungsprogramme ein[3], während das Unternehmen Alnylam Pharmaceuticals erfolgreich die o.a. vier RNAi-Therapeutika zur Zulassung brachte.
Auch einige bei Affen wirksame Medikamente gegen Filoviren, wie Marburg- und Ebola-Viren, basieren auf siRNA.[4]
Literatur
- H. Siomi, M. C. Siomi: On the road to reading the RNA-interference code. In: Nature. Band 457, Nr. 7228, Januar 2009, S. 396–404, doi:10.1038/nature07754, PMID 19158785.
- M. Jinek, J. A. Doudna: A three-dimensional view of the molecular machinery of RNA interference. In: Nature. Band 457, Nr. 7228, Januar 2009, S. 405–412, doi:10.1038/nature07755, PMID 19158786.
- S. M. Elbashir, J. Harborth, W. Lendeckel, A. Yalcin, K. Weber, T. Tuschl: Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. In: Nature. Band 411, 2001, S. 494–498, PMID 11373684.
Einzelnachweise
- J. Haasnoot, E. M. Westerhout, B. Berkhout: RNA interference against viruses: strike and counterstrike. In: Nat. Biotechnol. Band 25, Nr. 12, Dezember 2007, S. 1435–1443, doi:10.1038/nbt1369, PMID 18066040.
- OPKO Health Announces Update on Phase III Clinical Trial of Bevasiranib, PM OPKO zum Abbruch vom 6. März 2009, abgerufen am 8. April 2021
- H. Ledford: Drug giants turn their backs on RNA interference. In: Nature. Band 468, Nummer 7323, November 2010, S. 487, doi:10.1038/468487a, PMID 21107398.
- Julia Merlot: Verwandt mit Ebola: Neues Medikament schützt Affen vor Marburgfieber. In: Spiegel online. 20. August 2014, abgerufen am 20. August 2014.