Linalylacetat
Linalylacetat ist ein Monoterpenoid-Ester mit der Summenformel C12H20O2. Es ist eine farblose Flüssigkeit mit einem frischen, süßen Geruch.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
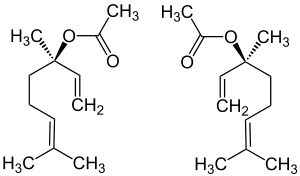 | ||||||||||||||||
| (R)-Form (links) und (S)-Form (rechts) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Linalylacetat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C12H20O2 | |||||||||||||||
| Kurzbeschreibung |
farblose, angenehm nach Bergamotte riechende Flüssigkeit[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 196,29 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,9 g·cm−3 [3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
220 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen

(R)-(–)-Linalylacetat findet sich als Hauptkomponente im Lavendelöl (30 – 60 %), im Lavandinöl (25 – 50 %), im Muskatellersalbeiöl (bis zu 75 %) und im Bergamottöl (30 – 45 %) und kommt darüber hinaus in vielen anderen ätherischen Ölen vor.[5]
Isomere
Die Substanz hat ein stereogenes Zentrum am Kohlenstoffatom der Position 3 und tritt somit in Form zweier Enantiomere auf.
| Isomere von Linalylacetat | ||
| Name | (R)-(–)-Linalylacetat | (S)-(+)-Linalylacetat |
| Strukturformel |  | |
| CAS-Nummer | 16509-46-9 | 51685-40-6 |
| 115-95-7 (Racemat) | ||
| PubChem | 442474 | 6999980 |
| 8294 (unspez.) | ||
| ECHA-Infocard | 100.003.743 (unspez.) | |
| FL-Nummer | 09.013 (Racemat) | |
Gewinnung und Darstellung
Linalylacetat lässt sich aus den oben erwähnten ätherischen Ölen gewinnen. Synthetisch lässt sich Linalylacetat durch Veresterung von Linalool gewinnen, wobei auf milde Reaktionsbedingungen geachtet werden muss, da Linalool als ungesättigter tertiärer Alkohol zur Dehydratisierung und Cyclisierung neigt. Geeignete Synthesewege ausgehend von Linalool wäre beispielsweise die Umsetzung mit Ethenon[6], mit kochendem Essigsäureanhydrid unter Abdestillation der entstehenden Essigsäure[7] oder eine Umesterung mittels Essigsäure-tert-butylester in der Gegenwart von Natriummethanolat.[8]
Aus Dehydrolinalool lässt es sich durch Veresterung mit Essigsäureanhydrid und anschließender partieller Hydrierung gewinnen.[9]
Ebenfalls eingesetzt wird die Umsetzung von β-Pinen mit Essigsäure und Natriumacetat in der Gegenwart von Kupfer(I)-chlorid, wobei Linalylacetat mit einer Ausbeute von 75 – 80 % entsteht.[10]
Linalylacetat zählt zu den chemischen Substanzen, die in großen Mengen hergestellt werden („High Production Volume Chemical“, HPVC) und für die von der Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) eine Datensammlung zu möglichen Gefahren („Screening Information Dataset“, SIDS) angefertigt wurde.[11]
Verwendung
Linalylacetat wird extensiv in der Parfümerie verwendet. Auf Grund seiner guten Stabilität im basischen Milieu wird es auch oft in Seifen oder Waschmitteln eingesetzt.[5]
Sicherheitshinweise
Die Dämpfe von Linalylacetat können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 94 °C, Zündtemperatur 225 °C) bilden.[3]
Einzelnachweise
- Eintrag zu LINALYL ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- Eintrag zu Linalylacetat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. November 2014.
- Eintrag zu Linalylacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- Richard J. Lewis, Sr.: Hawley's Condensed Chemical Dictionary. 15. Auflage. Wiley-Interscience, 2007, ISBN 978-0-471-76865-4 (englisch).
- Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe und Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA, 2003, ISBN 3-527-30673-0, doi:10.1002/14356007.a11_141.
- Patent GB878680: Production of linalyl acetate. Veröffentlicht am 4. Oktober 1961, Anmelder: Distillers Company, Erfinder: Peter Nayler.
- Patent DE2025727: Process for esterification of tertiary terpenic alcohols. Veröffentlicht am 3. Dezember 1970, Anmelder: Rhône-Poulenc Ind., SA, Erfinder: P. S. Gradeff, B. Finer.
- Patent DE1768980: Verfahren zur Herstellung von Carbonsaeureestern olefinisch ungesaettigter tertiaerer Alkohole. Veröffentlicht am 12. August 1971, Anmelder: BASF, Erfinder: H. Pasedach.
- Patent GB774621: Novel acetylenic esters and the conversion thereof into further esters. Veröffentlicht am 15. Mai 1957, Anmelder: Hoffmann-La Roche, Erfinder: J. A. Birbiglia, G. O. Chase, J. Galender.
- Patent US3076839: Process for producing allylic esters. Veröffentlicht am 5. Februar 1963, Anmelder: Glidden Co, Erfinder: R. L. Webb.
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Linalylacetate, abgerufen am 3. Oktober 2014.
