Durchflusszytometrie
Der Begriff Durchflusszytometrie (Zytometrie = Zell-Vermessung) beschreibt ein Messverfahren, das in der Biologie und in der Medizin zur Anwendung kommt. Es erlaubt die Analyse von Zellen, die in hoher Geschwindigkeit einzeln an einer elektrischen Spannung oder einem Lichtstrahl vorbeifließen. Je nach Form, Struktur und/oder Färbung der Zellen werden unterschiedliche Effekte erzeugt, aus denen die Eigenschaften der Zelle abgeleitet werden können.
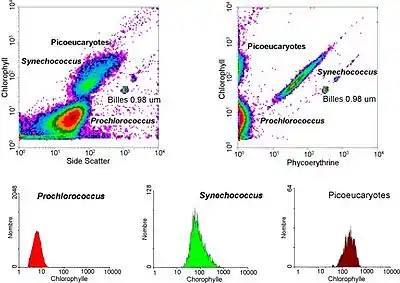
Bei einer Form der Durchflusszytometrie werden Fluoreszenz-markierte Zellen je nach Färbung in unterschiedliche Reagenzgefäße sortiert. Entsprechende Geräte werden als flow sorter (auf deutsch: Fluss-Sortierer) oder als FACS (=fluorescence-activated cell sorting) bezeichnet. FACS ist jedoch eine geschützte Handelsmarke eines Geräteherstellers. Manchmal wird der Begriff FACS (=fluorescence-activated cell scanning) mit dieser Bedeutung für Geräte verwendet, die keine Sortierung der Zellen, sondern nur eine Analyse ihrer Eigenschaften durchführen.
Geschichte
Die fluoreszenzbasierte Durchflusszytometrie wurde 1968 an der Westfälischen Wilhelms-Universität Münster von Wolfgang Göhde entwickelt und am 18. Dezember 1968 zum Patent angemeldet.[1] Zu der Zeit wurden Absorptionsmethoden noch weitgehend favorisiert und im Vergleich zu fluoreszenzbasierten Verfahren als weit überlegen angesehen, insbesondere in den USA.[2]
Das weltweit erste kommerziell erhältliche fluoreszenzbasierte Durchflusszytometer war das ICP 11 des deutschen Entwicklers und Herstellers Partec (lizenziert an die Phywe AG Göttingen),[3] gefolgt vom Cytofluorograph (Bio/Physics Systems 1971, später Ortho Diagnostics), das PAS 8000 (1973) von Partec, die erste Generation von FACS-Geräten von Becton Dickinson (1974, Hinweis: „FACS“ ist ein eingetragenes Warenzeichen des Unternehmens BD), das ICP 22 (1975) von Partec/Phywe bzw. ICP 22A (1977) von Partec/Ortho Instruments und das EPICS von Coulter Electronics (1977/78).
Zuerst wurde diese Technik für eukaryotische Zellen verwendet. Es kann aber auch für die Analyse von Bakterien verwendet werden.
Der Begriff Durchflusszytometrie (engl. „flow cytometry“) wurde auf der „5th American Engineering Foundation Conference on Automated Cytology“ in Pensacola (Florida) im Jahr 1976 als Standardbegriff für die Technologie bestimmt.[4]
Prinzip
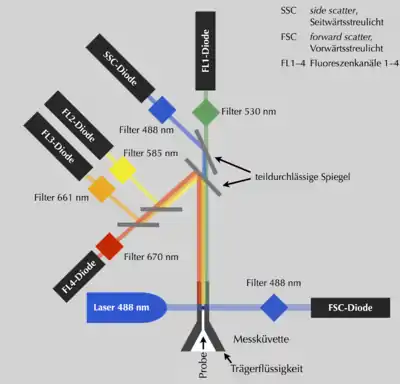
Das Prinzip der Untersuchung beruht auf der Emission von optischen Signalen seitens der Zelle, wenn diese einen Laserstrahl passiert. Durch einen Hüllstrom fokussiert, tritt die Probe in den Mikrokanal einer hochpräzisen Küvette aus Glas oder Quarz ein, sodass jede Zelle einzeln nacheinander durch den Messbereich eines Laserstrahls geführt wird. Das dabei entstehende Streulicht oder Fluoreszenzsignal wird von einem Detektor ausgewertet. Das Ergebnis sind quantitative Informationen über jede einzelne analysierte Zelle. Durch die Analyse einer großen Anzahl von Zellen innerhalb eines sehr kurzen Zeitintervalls (>1000 Zellen/sec) erhält man schnell repräsentative Informationen über Zell-Populationen. Die Menge des gestreuten Lichts korreliert mit der Größe der Zelle und mit ihrer Komplexität. So streuen Granulozyten, die eine raue Oberfläche und in ihrem Inneren viele Vesikel haben, deutlich mehr Licht als die sehr glatten T-Zellen. Das Vorwärtsstreulicht (FSC = Forward Scatter) ist ein Maß für die Beugung des Lichts im flachen Winkel und hängt vom Volumen der Zelle ab. Das Seitwärtsstreulicht (SSC = Side Scatter) ist ein Maß für die Brechung des Lichts im rechten Winkel, die von der Granularität der Zelle, der Größe und Struktur ihres Zellkerns und der Menge der Vesikel in einer Zelle beeinflusst wird. Mit diesen beiden Parametern lassen sich zum Beispiel die Zellen des Blutes bereits recht gut unterscheiden.
Fluoreszenzmessungen
Zugleich mit dem gestreuten Licht kann man im Durchflusszytometer Fluoreszenzfarben messen. Nur wenige Zellen emittieren per se fluoreszierendes Licht. Daher verwendet man Farbstoffe, die an bestimmte Bestandteile der Zellen binden. Setzt man z. B. die Farbstoffe DAPI und Propidiumiodid ein, welche an die DNA einer Zelle binden (DAPI) bzw. in diese interkalieren (Propidiumiodid) - d. h. sich zwischen die Basen einlagern -, kann man anhand der Helligkeit der Zelle untersuchen, wie viel DNA sie enthält. Auch Antikörper, die mit Fluoreszenzfarbstoffen markiert sind, können verwendet werden. Die Antikörper sind meist gegen bestimmte Oberflächenproteine (z. B. Proteine der CD-Klassifizierung; CD = Cluster of differentiation) gerichtet. Nach Markierung kann dann auch die Sortierung nach diesen Merkmalen erfolgen. Durch Einsatz von verschiedenfarbigen Lasern und vor allem Filtern kann die Anzahl der einsetzbaren Farbstoffe und damit die Informationsdichte erhöht werden.
Aufbau eines Durchflusszytometers
Das Durchflusszytometer besteht aus
- der Durchflussmesszelle: Durch diese Mikrokanalküvette aus Glas und Quarz wird die Zellsuspension in einem sehr dünnen Strahl geleitet. Hier findet die Messung statt.
- der Lichtquelle: Meist mehrere Laser, aber auch Xenon- oder Argonlampen können verwendet werden.
- den Filtern zur Auftrennung der Fluoreszenzsignale auf verschiedene Detektoren.
- den Detektoren: In der Regel werden Photomultiplier verwendet, um die eingehenden Signale zu verstärken. Die Messung kann linear oder logarithmisch erfolgen.
- dem Computer.
Fluorescence-activated Cell Sorting (FACS)
_B.jpg.webp)
Ein FACS-Gerät besitzt nach den Fluoreszenzdetektoren zusätzlich einen Vibrator zur Unterteilung des Flüssigkeitsstroms in kleine Tröpfchen ("hydrodynamische Fokussierung" beschreibt das Erreichen eines dünneren Probenstrahls bzw. Probenstroms innerhalb der Fließzelle durch den Hüllstrom.) und einen elektrostatischen Sortiermechanismus. Die Tröpfchengröße ist so gewählt, dass nur wenig mehr als eine Zelle hineinpasst, was zu einer Vereinzelung führt. An der Elektrode des Sortiermechanismus wird der Tropfen bei einer zu sortierenden Zelle umgekehrt polarisiert und fällt durch ein elektrisches Feld in ein anderes Gefäß als nicht zu sortierende Zellen. Der Begriff FACS ist ein eingetragenes Warenzeichen von Becton Dickinson, wird jedoch als generischer Begriff für alle Zellsortierungen anhand einer Fluoreszenz verwendet. Der Vorläufer des FACS sortierte anhand bestimmter Impedanzänderungen und wurde 1965 von Mack Jett Fulwyler bei Beckman Coulter entwickelt.[5] Das FACS wurde 1969 von Leonard A. Herzenberg entwickelt,[6] der dafür 2006 den Kyoto-Preis erhielt.
High-Throughput-Screening
Das optische Prinzip des Durchflusszytometers ähnelt sehr stark dem des (Fluoreszenz-) Mikroskops. Im Gegensatz zum Mikroskop kann man im Durchflusszytometer bis zu 10.000 Zellen pro Sekunde typisieren. Die Kontrolle der Messung ist in Echtzeit möglich.
Die im Durchflusszytometer gesammelten Daten werden in Graphen dargestellt, in denen ein oder zwei Parameter zugleich betrachtet werden. Eine Teilmenge der Zellen, die innerhalb einer frei wählbaren Region liegen, kann mit Hilfe eines sogenannten „Gates“ für weitere Analysen ausgewählt werden. Durch Sequenzen von sequentiellen Gates können detaillierte Analysen gemacht werden.
Darstellung von Durchflusszytometriedaten
Durchflusszytometriedaten werden typischerweise auf zwei Arten dargestellt: Histogramme, die nur einen einzelnen Parameter messen oder vergleichen, und Dotplot, die zwei oder drei Parameter gleichzeitig auf einem zwei- oder dreidimensionalen Streudiagramm vergleichen. Ein Histogramm zeichnet typischerweise die in einem einzigen Kanal erfasste Intensität entlang einer Achse auf. Die Anzahl der bei dieser Intensität erfassten Ereignisse liegt in einer separaten Achse. Eine große Anzahl von Ereignissen, die mit einer bestimmten Intensität erfasst wurden, wird als Spitze auf dem Histogramm angezeigt. Werden zwei oder drei verschiedene Parameter während einer Messung erfasst, reicht ein Histogramm nicht aus. Man bedient sich einer mehrdimensionalen Darstellung – dem Punktdiagramm bzw. Dotplot – um so die Korrelationsverteilung der Parameter zeigen zu können. Anders als im Histogramm wird im Dotplot jedes Ereignis als ein einzelner Punkt auf einem Streudiagramm dargestellt. Die Intensität von zwei verschiedenen Kanälen (oder drei verschiedenen Kanälen in einer dreidimensionalen Darstellung) wird entlang der verschiedenen Achsen dargestellt.
Anwendung
Die Durchflusszytometrie wird in der Klinik für die Routinediagnostik unter anderem in der Hämatologie, Infektiologie und Immunologie eingesetzt. Ein weiteres großes Einsatzgebiet stellt die medizinische und zellbiologische Grundlagenforschung dar. Außerdem wird dieses Verfahren auch in der Biotechnologie verwendet, z. B. um Spermazellen mit dem Geschlechtschromosom X und solche mit dem Chromosom Y voneinander zu trennen (wobei dazu auch die Dichtegradientenzentrifugation geeignet ist). Somit kann man das Geschlecht eines durch In-vitro-Fertilisation erzeugten Embryos bestimmen, indem vor der In-vitro-Fertilisation die Spermien mit einem X und einem Y-Chromosom getrennt werden.
Eine weitere Anwendung ist in der Biologie die quantitative Untersuchung von Zellen. Neben der einfachen Bestimmung der Zellzahlen können durch Anfärben der Zellen zumeist mit dem fluoreszierenden DNA-Farbstoff SYBR Green I im Zuge einer Zellviabilitätsbestimmung lebende von toten Zellen unterschieden werden. Propidiumiodid gelangt nur in Zellen mit nicht mehr intakter Zellmembran und färbt somit nur tote Zellen. In Kombination mit einem DNA-Farbstoff kann der Anteil der toten Zellen von der Gesamtzellzahl bestimmt werden. Außerdem können Zellfunktionen (wie z. B. Phagozytose, reaktive Sauerstoffspezies, LE-Zell-Test) mit Hilfe der Durchflusszytometrie analysiert werden.[7]
Ende 2012 ist die Durchflusszytometrie als empfohlene Methode zur Bestimmung der Totalzellzahl in Süßwasser in das Schweizerische Lebensmittelbuch aufgenommen worden.[8]
Lebensmittel
In der Lebensmittelanalytik kann die Durchflusszytometrie für die Bestimmung der Keimzahl in Rohmilch eingesetzt werden.[9] In vielen Betrieben wird die zytometrisch bestimmte Lebendkeimzahl auch für die Endproduktkontrolle eingesetzt.[10] Dies gilt insbesondere bei der Warenfreigabe von modernen Varianten wie UHT-Milch oder ESL-Milch, bei der die Haltbarkeit ein besonders wichtiges Qualitätsmerkmal ist.[11]
Literatur
- Bacterial Detection and Live/Dead Discrimination by Flow Cytometry. Application Note von BD Biosciences (April 2002)
- G. Nebe-von-Caron, P. J. Stephens u. a.: Analysis of bacterial function by multi-colour fluorescence flow cytometry and single cell sorting. In: Journal of microbiological methods. Band 42, Nummer 1, September 2000, S. 97–114. PMID 11000436 (Review).
Einzelnachweise
- Patent DE1815352: FLOW-THROUGH CHAMBER FOR PHOTOMETERS TO MEASURE AND COUNT PARTICLES IN A DISPERSION MEDIUM. Angemeldet am 18. Dezember 1968, Erfinder: Wolfgang Dittrich, Wolfgang Göhde.
- L. Kamentsky: In: D. M. D. Evans (Hrsg.): Proceedings of the 1968 Conference „Cytology Automation“. 1970.
- U. Sack u. a.: Zelluläre Diagnostik. Karger Publishers, 2006.
- G. Valet: Past and present concepts in flow cytometry: A European perspective. In: Journal of Biological Regulators and Homeostatic Agents. Wichtig Editore, 2003.
- M. J. Fulwyler: Electronic separation of biological cells by volume. In: Science. Band 150, Nr. 3698, 1965, S. 910–911. PMID 5891056.
- H. R. Hulett, W. A. Bonner, J. Barrett, L. A. Herzenberg: Cell sorting: automated separation of mammalian cells as a function of intracellular fluorescence. In: Science. Band 166, Nr. 3906, 1969, S. 747–749. PMID 4898615.
- I. Böhm: Flow cytometric analysis of the LE cell phenomenon. In: Autoimmunity. 37, 2004, S. 37–44.
- Im Trinkwasser lebt viel mehr als bisher angenommen. Medienmitteilungen des Bundesrates, Dübendorf, 24. Januar 2013.
- Amtliche Sammlung von Untersuchungsmethoden gemäß § 64 LFGB: L 01.01-7:2002-05 Untersuchung von Lebensmitteln – Bestimmung der Keimzahl in Rohmilch – Durchflusszytometrische Zählung von Mikroorganismen (Routineverfahren), Beuth Verlag, Mai 2002.
- Burkhard Schütze: Mikrobiologische Ergebnisse in wenigen Minuten, LVT Lebensmittel Industrie, März 2016.
- Damit die Milch in Ordnung ist – Hightech-Keimzahlbestimmung mit Durchflusszytometrie, LABO online, 26. Mai 2016.