Aluminiumfluorid
Aluminiumfluorid ist ein Salz von Aluminium und Fluor mit der Summenformel AlF3.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
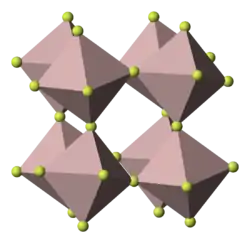 | ||||||||||
| _ Al3+ _ F− | ||||||||||
| Allgemeines | ||||||||||
| Name | Aluminiumfluorid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | AlF3 | |||||||||
| Kurzbeschreibung |
farblose hexagonale Kristalle[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 83,98 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
2,88 g·cm−3[2] | |||||||||
| Sublimationspunkt | ||||||||||
| Löslichkeit |
schlecht löslich in Wasser, Säuren und Laugen[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| MAK |
1 mg·m−3 (gemessen als einatembarer Aerosolanteil)[2] | |||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 |
−1510,4(13) kJ/mol[4] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Vorkommen
Aluminiumfluorid kommt sowohl wasserfrei, als auch in mehreren kristallwasserhaltigen Formen vor.
Synthese
Die Darstellung von Aluminiumfluorid erfolgt zweckmäßig durch das Überleiten von Fluorwasserstoff über rotglühendes Aluminiumoxid:
Eine mögliche Dehydrierung des aus wässriger Lösung gewinnbaren Trihydrats (AlF3·3 H2O) ist allerdings nie ganz frei von der Produktion eines Hydrolyseproduktes, das Oxid (Al2O3) bzw. Oxifluorid (AlOF) enthält. Um daher reines wasserfreies Aluminiumfluorid herzustellen, greift man auf die Zersetzung von Ammoniumhexafluoroaluminat zurück:[5]
Eigenschaften
Aluminiumfluorid bildet ein in Wasser und organischen Lösungsmitteln schwer lösliches, farbloses trigonales Kristallpulver mit der Raumgruppe R3 (Raumgruppen-Nr. 148) und den Gitterparametern a = 4,9254 Å, c = 12,4477 Å.[6]
Reaktionsverhalten
Mit Fluoriden der Alkalimetalle werden Komplexsalze der Zusammensetzungen M(AlF4), M2(AlF5) sowie M3(AlF6) gebildet.[1] Von technischer Bedeutung ist hierbei Kryolith Na3[AlF6].
Verwendung
Aluminiumfluorid wird ebenso als Katalysator, wie auch bei der Zahnpflege zur Kariesprophylaxe eingesetzt. In reiner Form wie auch als Kryolith wird es als Flussmittel zum Schmelzen von Leichtmetallen und zur Herstellung von Aluminium verwendet[2]. So kann die Schmelztemperatur von Aluminiumoxid von ca. 2000 °C auf 1000 °C gesenkt werden.
Einzelnachweise
- Eintrag zu Aluminiumfluorid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- Eintrag zu Aluminiumfluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Dezember 2007. (JavaScript erforderlich)
- Datenblatt Aluminum fluoride bei Sigma-Aldrich, abgerufen am 20. März 2011 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, CODATA Key Values for Thermodynamics, S. 5-1.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 225–226.
- R. Hoppe, D. Kissel: Zur Kenntnis von AlF3 und InF3. In: Journal of Fluorine Chemistry, 1984, 24, S. 327–340 doi:10.1016/S0022-1139(00)81321-4
