Cobaltocen
Cobaltocen (Di(cyclopentadienyl)cobalt oder Bis(cyclopentadienyl)cobalt), mit der Halbstrukturformel [Co(Cp)2] oder auch [Co(C5H5)2], ist ein Metallocen, das heißt eine metallorganische Verbindung mit aromatischen Ringsystemen. Cobaltocen ist strukturell mit dem sehr stabilen Ferrocen verwandt. Es wurde zuerst 1953 von E. O. Fischer synthetisiert.[6]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
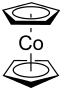 | ||||||||||||||||
| Gestaffelte Konformation | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cobaltocen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C10H10Co | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 189,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften

Cobaltocen bildet schwarze Kristallnadeln mit einem Schmelzpunkt von 176–180 °C. In unpolaren Lösungsmitteln wie Hexan oder Toluol ist es gut löslich. Cobaltocen ist sehr luftempfindlich, da an Luft eine rasche Oxidation zum Cobaltoceniumhydroxid[7], welches das gelbgrüne[1] oder gelbe[8] Cobaltocenium-Kation, den 18-Elektronenkomplex [Co(Cp)2]+ (Cp = Cyclopentadienyl) enthält, erfolgt.[9]
Bindungsverhältnisse
Cobaltocen setzt sich formal aus einem Cobalt(II)-Kation und zwei Cyclopentadienyl-Anionen (C5H5−) zusammen. Insgesamt ergibt sich also ein ungeladener Komplex. Die Bindungsverhältnisse sind ähnlich denen des Ferrocens: Die Cyclopentadienyl-Anionen verfügen als Aromaten über ein delokalisiertes π-Elektronensystem. Jeder dieser beiden Liganden kann dem Co(II)-Kation 6 π-Elektronen zur Verfügung stellen. Das Cobalt(II)-Kation besitzt selbst 7 Elektronen in der Valenzschale, es erhält also noch 12 Elektronen von den Liganden, so dass es im Komplex 7 + 12 = 19 Valenzelektronen besitzt. Damit hat es ein Elektron mehr, als nach der 18-Elektronen-Regel günstig wäre, so dass dieses Elektron ein antibindendes Molekülorbital besetzen muss. Dieser Umstand erklärt auch die leichte Oxidierbarkeit von Cobaltocen zum Kation mit 18 Valenzelektronen. Der Cp-Cp Abstand beträgt 340 pm. Damit ist er etwas länger als im Ferrocen (332 pm), was durch die Besetzung eines antibindenden Orbitals mit einem Elektron zu erklären ist.
Darstellung
Die Darstellung von Cobaltocen kann durch Reaktion von wasserfreiem Cobalt(II)-chlorid oder Hexamincobalt(II)-chlorid mit Cyclopentadienylnatrium in Tetrahydrofuran (THF) erfolgen. Die Reaktion muss unter Schutzgas durchgeführt werden, weil die Edukte und das Produkt der Reaktion luftempfindlich sind. Das Produkt kann dann durch Sublimation im Vakuum isoliert und gereinigt werden.
Einzelnachweise
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente, 1. Auflage, Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9, Seite 1463
- Wolfgang A. Herrmann, Georg Brauer: Synthetic Methods of Organometallic and Inorganic Chemistry - Volume 8: Transition Metals Part 2, Thieme, Stuttgart 1997, ISBN 3-13-103091-7, Seite 13
- Datenblatt Cobaltocen bei AlfaAesar, abgerufen am 8. Februar 2010 (PDF) (JavaScript erforderlich)..
- Datenblatt Cobaltocen bei Acros, abgerufen am 24. Februar 2010..
- Datenblatt Bis(cyclopentadienyl)cobalt(II) bei Sigma-Aldrich, abgerufen am 8. November 2019 (PDF).
- E. O. Fischer, R. Jira: Di-cyclopentadienyl-kobalt(II). In: Zeitschrift für Naturforschung B. 8, 1953, S. 327–328 (online).
- Christoph Elschenbroich: Organometallchemie, 6. Auflage, Teubner, Leipzig 2008, ISBN 978-3-8351-0167-8, Seite 469
- Peter L. Pauson "Bis(cyclopentadienyl)cobalt Hexafluorophosphate" e-EROS Encyclopedia of Reagents for Organic Synthesis e-EROS 2001, John Wiley & Sons, doi:10.1002/047084289X.rb123
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.

