Nickelocen
Nickelocen (Di(cyclopentadienyl)nickel oder Bis(cyclopentadienyl)nickel(II)), mit der Halbstrukturformel [Ni(Cp)2] oder auch [Ni(C5H5)2], ist ein Sandwichkomplex, das heißt eine metallorganische Verbindung mit aromatischen Ringsystemen (Metallocen). Nickelocen ist strukturell mit dem sehr stabilen Ferrocen verwandt, jedoch im Gegensatz zu diesem nicht luftbeständig. Es wurde zuerst 1953 von E. O. Fischer synthetisiert.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
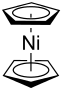 | |||||||||||||||||||
| Gestaffelte Konformation | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Nickelocen | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H10Ni | ||||||||||||||||||
| Kurzbeschreibung |
dunkelgrüner, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 188,88 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Bindungsverhältnisse

Nickelocen setzt sich formal aus einem Nickel(II)-Kation und zwei Cyclopentadienyl-Anionen (C5H5−) zusammen. Insgesamt ergibt sich also ein ungeladener Komplex. Die Bindungsverhältnisse sind ähnlich denen des Ferrocens: Die Cyclopentadienyl-Anionen verfügen als Aromaten über ein delokalisiertes π-Elektronensystem. Jeder dieser beiden Liganden kann dem Ni(II)-Kation 6 π-Elektronen zur Verfügung stellen. Das Nickel(II)-Kation besitzt selbst 8 Valenzelektronen, es erhält also noch 12 Elektronen von den Liganden, so dass es im Komplex 8 + 12 = 20 Valenzelektronen besitzt. Damit hat es zwei Elektronen mehr, als nach der 18-Elektronen-Regel günstig wären, so dass diese beiden Elektronen ein antibindendes Molekülorbital besetzen müssen. Dieser Umstand erklärt auch die leichte Oxidierbarkeit von Nickelocen.
Eigenschaften
Nickelocen ist ein dunkelgrüner, kristalliner Feststoff, der leidlich luftbeständig ist und sich leicht oxidieren lässt.[4]
Darstellung
Nickelocen kann durch diverse Salzmetathesereaktionen z. B. aus Natriumcyclopentadienid mit Nickel(II)-chlorid hergestellt werden.
Analog zum Ferrocen ist Nickelocen durch die Umsetzung von Cyclopentadien mit Nickel(II)-chlorid in einem inerten Lösemittel und einem Überschuss von Kaliumhydroxid, welches sowohl als Deprotonierungsreagenz für das Cyclopentadien, als auch als Dehydratisierungsmittel dient zugänglich:[4]
Im Vakuum lässt sich die Verbindung bei 100 °C durch Sublimation aufreinigen.[4]
Verwendung
Durch Behandlung mit Salpetersäure kann Cyclopentadienyl-Nickel-Nitrosyl gewonnen werden.[5]
Einzelnachweise
- Datenblatt Bis(cyclopentadienyl)nickel (PDF) bei Strem, abgerufen am 25. Dezember 2012.
- Datenblatt Bis(cyclopentadienyl)nickel(II) bei Sigma-Aldrich, abgerufen am 16. April 2011 (PDF).
- E. O. Fischer, R. Jira: Di-cyclopentadienyl-nickel. In: Zeitschrift für Naturforschung B. 8, 1953, S. 217–219 (PDF, freier Volltext).
- William L. Jolly and David J. Chazan: Bis(cyclopentadienyl)nickel (Nickelocene). In: William L. Jolly (Hrsg.): Inorganic Syntheses. Band 11. McGraw-Hill Book Company, Inc., 1968, S. 122–123 (englisch).
- Linus Pauling: The nature of the chemical bond and the structure of molecules and crystals : an introduction to modern structural chemistry. Cornell University Press, Ithaca, N.Y 1960, ISBN 978-0-8014-0333-0.
Literatur
- Christoph Elschenbroich: Organometallchemie. 6. Auflage, Wiesbaden 2008, ISBN 978-3-8351-0167-8.
