Felines Immundefizienz-Virus
Das Feline Immundefizienz-Virus (FIV) ist ein Virus aus der Familie der Retroviren (Retroviridae). Das Virus löst bei Katzen eine Immunschwächekrankheit aus, die als Felines Immundefizienzsyndrom oder umgangssprachlich als Katzen-AIDS bezeichnet wird, da sie der Erkrankung AIDS beim Menschen stark ähnelt. Menschen können sich jedoch mit FIV nicht infizieren. FIV gehört innerhalb der Retroviren zur Gattung der Lentiviren und wurde 1986, also vier Jahre nach der Entdeckung des Humanen Immundefizienz-Virus (HIV), zum ersten Mal beschrieben. Die Erkrankung ist bisher nicht wirkungsvoll behandelbar, verläuft aber oft über lange Zeit symptomlos. Langfristig wird jedoch das Immunsystem zerstört und Sekundärinfektionen führen zum Tod. Bisher wurden neun verschiedene Stämme des Virus aus elf verschiedenen Katzenarten isoliert, darunter spezifische Stämme aus Löwen und Pumas. Auch in der Tüpfelhyäne, die nicht zur Familie der Katzen gehört, wurde FIV gefunden. Neben dem Felinen Coronavirus, dem Erreger der felinen infektiösen Peritonitis (FIP) und dem Felinen Leukämievirus (FeLV), dem Erreger der Katzenleukämie, gehört das Virus zu den Auslösern der klinisch bedeutsamsten viralen Infektionskrankheiten bei Hauskatzen.
| Felines Immundefizienz-Virus | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||||||||
| ||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||
| ||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||
| Feline immunodeficiency virus | ||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||
| FIV | ||||||||||||||||||||
| Links | ||||||||||||||||||||
|
Geschichte, Verbreitung und Nomenklatur
Die ersten FIV-Virusstämme wurden 1986 aus Hauskatzen isoliert. In einem Haushalt in Petaluma, Kalifornien, in dem sehr viele Katzen lebten, kam es zu einem Ausbruch einer Immunschwächekrankheit. Diese Tiere wurden auf das Feline Leukämievirus (FeLV) getestet, waren aber alle negativ. Man entnahm ihnen Blutproben und injizierte diese in zwei gesunde Tiere, die nach vier bis sechs Wochen Fieber, eine Abnahme der Zahl der weißen Blutkörperchen (Leukopenie) und eine Lymphknotenschwellung entwickelten. Aus den mononukleären peripheren Blutzellen (PBMCs) dieser Tiere wurde anschließend das erste FIV isoliert.

Bald darauf wurde festgestellt, dass auch Serumproben von wild lebenden Katzen wie afrikanischen Löwen und Geparden, asiatischen Löwen und Tigern, südamerikanischen Jaguaren und nordamerikanischen Pumas mit den Antigenen von FIV und EIAV, einem Pferdelentivirus, kreuzreagierten. Diese Reaktionen deuteten auf eine Infektion mit FIV hin. Serologische Untersuchungen dieser Art (zum Beispiel mittels ELISA) sind bis heute die wichtigste Methode, um eine Infektion mit FIV nachzuweisen. Zunächst wurden die Antigene der Hauskatzen auch für Tests der Seren von wild lebenden Katzenarten verwendet. Mit zunehmender Charakterisierung der speziesspezifischen FIV-Stämme wurden deren Antigene verwendet, was die Sensitivität der Tests stark erhöhte. Gleichzeitig wurde erkannt, dass FI-Viren eine große und evolutionär gesehen alte Gruppe von Retroviren sind.
Nach der ersten Beschreibung aus Nordamerika wurde nach und nach in Hauskatzen aus aller Welt ebenfalls FIV nachgewiesen. Die weltweite Prävalenz von FIV-infizierten Hauskatzen in den Regionen und Ländern liegt zwischen zwei und 30 Prozent. Da die Hauskatze bereits vor Hunderten von Jahren von Europa aus mit den Händlern und Entdeckern in alle Welt verbreitet wurde, kann davon ausgegangen werden, dass auch FIV Hauskatzen bereits seit langer Zeit infiziert waren. Auch eingefrorene Katzenseren – die ältesten getesteten Seren stammen von 1968 aus Japan und den USA – lieferten positive Serotests. Die Zahlen über die Verbreitung schwanken in Abhängigkeit von der Vorselektion des Probenmaterials und der Populationsdichte.[2][3][4] Auch in verschiedenen geografischen Regionen treten große Schwankungen auf. Die Löwen in der Serengeti sind praktisch zu 100 Prozent seropositiv, während die Löwen in Namibia und freilebende Asiatische Löwen durchweg seronegativ sind. Pumas in Wyoming sind fast zu 100 Prozent positiv, während Pumas in Montana nur zu 20 Prozent positiv sind. Weil die evolutionäre Entwicklung von Lentiviren schneller verläuft als die von Katzenarten, lassen die Verbreitung und Ähnlichkeit der FIV-Stämme Rückschlüsse auf Ausbreitung, Territorien, Wanderungsverhalten und Populationsdynamiken der verschiedenen Katzenarten zu.[5] Die Erfassung und Analyse dieser Daten steht jedoch noch am Anfang.
Die Bezeichnung des Virus mit FIV bezieht sich in den meisten Fällen auf das Isolat aus Hauskatzen. Die Standardnomenklatur für die Bezeichnung von Stämmen aus verschiedenen Spezies ist ein hintenangestelltes Kürzel, das sich aus dem ersten Buchstaben des Gattungsnamens und aus den ersten beiden Buchstaben des Artnamens zusammensetzt. Das FIV der Hauskatze (Felis catus) wird daher auch als FIVfca bezeichnet, das des Afrikanischen Löwen (Panthera leo) heißt FIVple und das von Puma concolor FIVpco. Das Puma-FIV wird manchmal auch als PLV und Löwen-FIV mit LLV bezeichnet, aber diese beiden Virusstämme sind im Bezug auf einen eigenen Namen die einzigen Ausnahmen von der Nomenklatur.
| Art | Virus | Untergruppen | Verbreitung (soweit untersucht) |
|---|---|---|---|
| Hauskatze (Felis catus) | FIV, FIVfca | fünf, A bis E | weltweit |
| Löwe (Panthera leo) | FIVple (LLV) | Afrika | |
| Puma (Puma concolor) | FICpco (PLV) | Nord-, Zentral- und Südamerika | |
| Rotluchs (Lynx rufus) | FIVlru | Kalifornien, Mitteleuropa | |
| Manul (Otocolobus manul) | FIVoma | Mongolei | |
| Jaguarundi (Puma yagouaroundi) | FIVhya | Zentral- und Südamerika | |
| Gepard (Acinonyx jubatus) | FIVaju | Afrika | |
| Leopard (Panthera pardus) | FIVppa | Afrika (Botswana), Asien | |
| Ozelot (Leopardus pardalis) | FIVlpa | Zentral- und Südamerika | |
| Tiger (Panthera tigris) | – | Asien, Zoos in Europa (infiziert mit FIVple) | |
| Tüpfelhyäne (Crocuta crocuta) und Streifenhyäne (Hyaena hyaena) | FIVccr | Serengeti |
Phylogenie
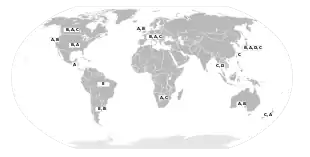
Die bisher bekannten FIV-Stämme sind sehr divergent, aber monophyletisch, also aus einer Stammform entstanden. Für drei der FIV-Stämme aus den verschiedenen Tierarten konnten Subtypen ermittelt werden. Das FIV der Hauskatze ist bisher am besten untersucht und weist fünf Subtypen auf, die weltweit in unterschiedlicher Häufigkeit vorkommen und die mit A bis E bezeichnet werden. Die Unterteilung in fünf Untergruppen erfolgte nach Vergleichen der DNA-Sequenz des env-Gens, das die Hüllproteine codiert. Die Untergruppen A bis C sind weltweit verbreitet, D kommt vor allem in Ostasien vor und E nur in Südamerika.
Auch von FIVple wurden drei Untergruppen bestimmt, bezeichnet mit A bis C. Diese Unterteilung erfolgte aufgrund von Sequenzunterschieden im pol-Gen, das die viralen Enzyme (Protease, Integrase und Reverse Transkriptase) codiert. Bei FIVpci wurden aufgrund der Unterschiede in pol zwei Untergruppen ermittelt und mit A und B bezeichnet. Die Unterschiede der DNA-Sequenz sind zwischen den einzelnen FIV-Stämmen zum Teil erheblich und liegen zum Beispiel für das pol-Gen von FIVple, FIVfca und FIVpco bei 30 Prozent.
Die bekannten FIV-Stämme bilden einen eigenen Cluster innerhalb der Lentiviren und können grob in Alt- und Neuweltspezies unterteilt werden. Die engste Verwandtschaft besteht zu den Lentiviren der Rinder und Pferde.
Aufbau
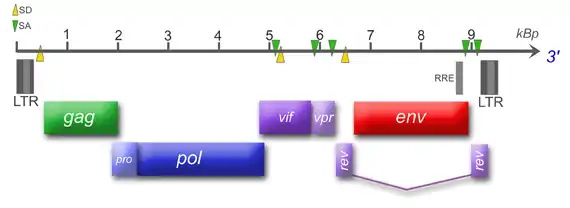
FIV ist aufgebaut wie andere Lentiviren, die Immunschwächesyndrome bei Säugetieren hervorrufen. Das vollständige Virion hat einen Durchmesser von 105 bis 125 Nanometer, ist sphärisch oder ellipsoid geformt und besitzt in der Virushülle kurze, wenig definierte Vorsprünge (Spikes), die aus den viralen Glykoproteinen gp95 und gp44 bestehen. Es hat wie andere Retroviren eine Dichte von 1,15 bis 1,17 Gramm pro Kubikzentimeter. Die Viruspartikel (Virionen) werden durch übliche alkohol- oder chlorhaltige Desinfektionsmittel zerstört und durch kurzzeitiges (wenige Minuten) Erhitzen auf 60 Grad Celsius inaktiviert.
Das Virusgenom ist diploid. Es besteht aus zwei identischen einzelsträngigen aus jeweils etwa 9400 Nukleotiden bestehenden RNA-Molekülen in Plus-Strang-Orientierung. Es besitzt die typische genomische Struktur der Retroviren, die aus den Genen gag-pol-env besteht, und hat wie andere Lentiviren zusätzliche (zusätzliche) Gene. Diese sind vif, vpr und rev. Es fehlen tat, vpu, vpx und nef, FIV ist damit weniger komplex als HIV. FIV besitzt eine Desoxyuridinpyrophosphatase (dUTPase), die in Lentiviren der Nicht-Primaten vorkommt und bisher außer für FIV noch für EIAV und das Visna-Maedi-Virus (VMV) beschrieben wurde. Die dUTPase wird in der pol-Region codiert, das fertige Enzym baut dUTP zu dUMP und Pyrophosphat ab, was dem Virus wahrscheinlich dabei hilft, einen falschen Einbau von dUTP in das Genom zu verhindern. Von dem proviralen Genom werden sechs verschiedene Spleißvarianten der mRNA erzeugt.
Pathogenität und Spezifität
- Dieser Artikel beschreibt die Infektionseigenschaften von FIV auf zellulärer Ebene, für den detaillierteren Krankheitsverlauf bei Katzen und die Übertragung des Virus siehe Felines Immundefizienzsyndrom
Die Pathogenität der FIV-Stämme ist für Katzen in freier Wildbahn nur schwer zu bestimmen. Epidemiologische Studien, in denen die Überlebensraten mit den Infektions- und Reproduktionsraten verglichen wurden, konnten keine statistisch signifikanten Nachteile für die infizierten Tiere feststellen. Viele der vorkommenden Stämme können somit als nicht pathogen angesehen werden. In Gefangenschaft dagegen, wenn sich die durchschnittliche Lebenserwartung der Tiere deutlich erhöht, kommt es zu der Entwicklung der Krankheitssymptome. Die geringe Pathogenität der FIV-Stämme bei wild lebenden Katzen deutet auf eine lange Pathogen-Wirt-Wechselwirkung hin, die wie bei SIV vermutlich seit etwa ein bis zwei Millionen Jahren besteht.[6] In welchen Vorläuferspezies sich FIV zunächst entwickelt hat, ist nicht bekannt. Übertragungen zwischen verschiedenen Katzenarten kommen in freier Natur nur selten vor, in Gefangenschaft dagegen häufiger.[7]
Das Feline Immundefizienz-Virus ist sehr wirtsspezifisch, Übertragungen von Katze zum Menschen sind nicht bekannt.[8] FIV infiziert wie HIV-1 hauptsächlich CD4-positive T-Lymphozyten. Im Vergleich zu HIV-1, einem der beiden bei Menschen vorkommenden Verwandten, hat FIV jedoch ein etwas breiteres Spektrum an Zellen, die es infizieren kann. Neben den CD4-positiven T-Zellen, Monozyten, Makrophagen und Gliazellen infiziert FIV auch CD8-positive T- und B-Zellen. Als primärer Rezeptor für das externe Glykoprotein (gp95) von FIV dient nicht wie bei HIV-1 CD4, sondern CD134.[9][10] Für die Interaktion zwischen FIV gp95 und CD134 wird CXCR4 als essentieller Korezeptor benötigt.[11] Das Hüllprotein gp95 des Virus bindet mit seinen Vorsprüngen (engl. spikes) an CD134, was eine Konformationsänderung in gp95 zur Folge hat, die eine Interaktion mit CXCR4 ermöglicht. Diese Interaktion mit dem Corezeptor regt die Fusion der Virushülle mit der Zellmembran an und ermöglicht den Eintritt in die Zelle. Da auch Virusstämme beschrieben wurden, die CD134 nicht benötigen, ist die Charakterisierung der Rezeptoren noch nicht vollständig abgeschlossen.
Es ist bisher in keinem einzigen Fall gelungen, das FI-Virus in menschlichen Zellen oder Zelllinien zur Vermehrung zu bringen. Der „Block“, also die Barriere, die das Virus daran hindert, einen vollständigen Replikationszyklus zu durchlaufen, liegt weder beim Zelleintritt noch bei der Überwindung der Kernmembran, sondern besteht darin, dass das in der DNA integrierte und nachweisbare Provirus den kritischen Schritt der Transkription nicht mehr durchläuft. Daher können nach der Infektion der Zelle keine weiteren Viruspartikel gebildet werden. Der Block ähnelt damit dem von EIAV in menschlichen Zellen und HIV in Mäusezellen.
Nach einer Erstinfektion produziert die Katze sofort virusspezifische Antikörper und cytotoxische T-Zellen, ist jedoch trotz der heftigen Immunreaktion nicht in der Lage, die Infektion vollständig zu überwinden. Das Virus verbleibt daher in allen bisher untersuchten Fällen dauerhaft im Körper.
FIV-Impfstoff
Relativ viel Aufmerksamkeit hat die Entwicklung eines FIV-Impfstoffs erhalten, der 2002 in den USA zugelassen wurde. Man erhofft sich aus den Erfahrungen Erkenntnisse für die Entwicklung eines Impfstoffs gegen HIV.[12] Die Entwicklung eines solchen Impfstoffs wurde seit Entdeckung des FI-Virus vorangetrieben,[13] und es wurden verschiedene Impfstofftypen getestet, darunter inaktivierte Viren, mit Viren infizierte Zellen, DNA-Impfstoffe und virale Vektoren. Es ist unklar, ob diese unter Laborbedingungen erbrachten Ergebnisse unter Feldbedingungen mit einer Vielzahl verschiedener FIV-Stämme reproduzierbar sind.
Wie bei HIV ist die Entwicklung einer wirksamen Impfung gegen FIV aufgrund der hohen Anzahl und Variationen der Virus-Stämme schwierig. Für sogenannte „single strain“-Vakzine, also Impfstoffe, die nur gegen eine vorkommende Virusvariante schützen, konnte bereits eine gute Wirksamkeit gegen homologe FIV-Stämme nachgewiesen werden. Mit der Entwicklung einer „dual-subtype“ FIV-Vakzine (Name: Fel-O-Vax FIV) wurde es möglich, Katzen auch gegen weitere FIV-Stämme zu immunisieren. Der Impfstoff besteht aus inaktivierten (abgetöteten) FIV-Partikeln der beiden Stämme Petaluma subtype A und Shizuoka subtype D.[14] Unter Laborbedingungen trat bei 82 Prozent der Katzenprobanden eine Immunität gegenüber FIV durch die Verabreichung des Impfstoffs auf.[15] Eine generelle Immunisierung gegen Primärisolate aus der freien Wildbahn scheint jedoch nach wie vor nur unzureichend möglich zu sein. Bisher konnten außerdem nur wenige Erkenntnisse aus der Impfstoffentwicklung für die Entwicklung eines HIV-Impfstoffs genutzt werden.[12] Wichtigster Kritikpunkt an dem zur Verfügung stehenden Impfstoff ist die Tatsache, dass geimpfte Tiere serologisch nicht von infizierten Tieren zu unterscheiden sind.[16] An der Entwicklung eines Tests zur Unterscheidung wird gearbeitet.
Durch das vergleichbare Krankheitsbild und die Möglichkeit einer Immunisierung spielt die Hauskatze dennoch eine zunehmend wichtige Rolle bei der Erforschung von HIV und Aids.[17]
FIV als viraler Vektor
Auf der Basis von FIV werden virale Vektoren für die Gentherapie beim Menschen entwickelt.[18] Als ein Vorteil von FIV wird dabei das fehlende Krankheitsbild beim Menschen angesehen. Die FIV-Vektoren werden auch in der Grundlagenforschung eingesetzt.
Übertragung von FIV
Hauptsächlich wird FIV über Bisswunden übertragen.[19] Dagegen ist die vertikale Übertragung (von Mutter zu Kind in utero oder über Milch) oder zwischen Katzen in einem stabilen Haushalt selten.[20] Experimentell ist FIV auch parenteral übertragbar, also intravenös, intraperitoneal oder subkutan.[21] Die Übertragung über Schleimhäute (Nase, Mund, Vagina, Rectum) ist experimentell ebenso möglich aber weitaus weniger effektiv als beim menschlichen HIV.[22] Viele Studien, die sich mit der Infektion von FIV-negativen (FIV-)Katzen in Haushalten mit FIV-positiven (FIV+) Katzen beschäftigten ergaben jedoch widersprüchliche Resultate. Hierbei wurde allerdings nicht auf die Aggression zwischen den Katzen geachtet, auch waren die Beobachtungszeiträume sehr kurz.[23]
Einige Studien befassten sich mit vertikaler Übertragung des Virus entweder nach experimentellen oder natürlichen Infektionen.[24][25][26]
In einer Studie[27] konnte keine vertikale oder horizontale Übertragung des Virus unter 25 Katzen (sechs FIV+, 19 FIV-) und 48 Katzenjunge (30 von FIV+ Katzen geboren) beobachtet werden (geschlossene Kolonie, Beobachtung von neun Monaten). Eine Studie zeigte die Übertragung eines natürlich infizierten Muttertiers an das Kind. Ebenfalls konnte bei chronisch experimentell infizierten Muttertieren gezeigt werden, dass etwa die Hälfte der Kinder ebenfalls FIV+ waren.[28] Infektion über die Milch fand laut Sellon et al. bei über 60 % der Katzenjungen von akut infizierten Katzen statt.[29] Bei vielen der oben genannten Studien handelt es sich allerdings um experimentell herbeigeführte Infektionen, die offenbar im Wesentlichen leichter infektiös sind als natürliche.
In einer Studie mit natürlich infizierten FIV+ Katzen konnte keine Übertragung von fünf FIV+ Katzen auf ihre 19 Katzenjungen festgestellt werden. Ebenfalls konnte keine Übertragung auf FIV- Katzen bei einer natürlichen Exposition mit FIV+ Katzen über 38 Monate festgestellt werden. Deshalb halten es die Autoren für unwahrscheinlich, dass bei natürlich infizierten Katzen es zu einer vertikalen oder horizontalen Übertragung kommen kann (ausgenommen über Bisswunden). Bei der Integration von neuen Katzen sollte demnach darauf geachtet werden, dass diese keine Aggressionen zeigen.[30]
Krankheitsverlauf
Werden Katzenjunge mit FIV infiziert, kommt es zu einem transienten Fieber (einige Tage bis hin zu zwei Wochen) und Neutropenie (Abnahme der weißen Blutkörperchen), die vier bis acht Wochen nach der Infektion beginnt. Dies wird begleitet von einer Lymphadenopathie (Schwellung der Lymphknoten), die bis zu neun Monate anhalten kann. Die meisten Katzen erholen sich von dieser initialen Phase und bleiben lebenslang Träger des Virus. Bei einer Anzahl von Katzen kommt es nach einer langen, asymptomatischen Phase zu Symptomen, die dem menschlichen AIDS ähnlich sind. Hierbei kann es zu Infektionen der Atemwege, des Gastrointestinaltraktes, der Harnröhre oder der Haut kommen. Ebenso sind Anämien, Neoplasmen (Tumore) oder neurologische Schäden möglich. Die letzteren können zu Demenz und Verhaltensstörungen führen.[31]
Die Prognose ist stark abhängig vom Alter der Katze während der Infektion. Neugeborene Katzen entwickeln Thymusatrophie, also einen Gewebsschwund des Thymus, der zu schweren Immundefekten und frühem Tod führt. Ältere Katzen zeigen oft rückläufige Infektionen oder mildere Verlaufsformen. Ebenso ist der FIV-Subtyp und die Exposition anderer Pathogene für die Länge der asymptomatischen Phase wichtig.[32][33]
Zusammenfassend kann man sagen, dass die meisten natürlicherweise infizierten FIV-Katzen keine schweren klinischen Symptome zeigen und noch Jahre nach der Infektion ohne gesundheitliche Probleme leben können.[33]
Behandlung
Es gibt bereits zahlreiche antivirale Medikamente, die die Replikation des FIV behindern. Der Wirkstoff AMD3100 zeigte gute Verträglichkeit bei Katzen und konnte die FIV-Replikation senken. Die Komponenten Zidovudin, Stavudin, PMEA, Dideoxycytidin, Fozivudin, WHI-07, Stampidin und Lamivudin konnten Virusreplikation in vivo und vitro verhindern und senkten den Virustiter bei chronisch infizierten Katzen. Atazanavir, Tipranavir, Lopinavir und TL-3 konnten ebenfalls die Virusreplikation hemmen, reduzierten neurodegenerative Effekte und wurden von den Katzen vertragen.[34]
Quellen und weiterführende Informationen
Einzelnachweise
- ICTV: ICTV Taxonomy history: Commelina yellow mottle virus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- M. J. Hosie, C. Robertson, O. Jarrett: Prevalence of feline leukaemia virus and antibodies to feline immunodeficiency virus in cats in the United Kingdom. In: The Veterinary Record. Band 125, Nr. 11, 9. September 1989, ISSN 0042-4900, S. 293–297, PMID 2554556.
- J. K. Yamamoto, H. Hansen, E. W. Ho, T. Y. Morishita, T. Okuda, T. R. Sawa, R. M. Nakamura, N. C. Pedersen: Epidemiologic and clinical aspects of feline immunodeficiency virus infection in cats from the continental United States and Canada and possible mode of transmission. In: Journal of the American Veterinary Medical Association. Band 194, Nr. 2, 15. Januar 1989, ISSN 0003-1488, S. 213–220, PMID 2537269.
- H. Yilmaz, A. Ilgaz, D. A. Harbour: Prevalence of FIV and FeLV infections in cats in Istanbul. In: Journal of Feline Medicine and Surgery. Band 2, Nr. 1, 1. März 2000, ISSN 1098-612X, S. 69–70, doi:10.1053/jfms.2000.0066, PMID 11716594.
- Roman Biek, Alexei J. Drummond, Mary Poss: A virus reveals population structure and recent demographic history of its carnivore host. In: Science. Band 311, Nr. 5760, 27. Januar 2006, ISSN 1095-9203, S. 538–541, doi:10.1126/science.1121360, PMID 16439664.
- Aris Katzourakis, Michael Tristem, Oliver G. Pybus, Robert J. Gifford: Discovery and analysis of the first endogenous lentivirus. In: Proceedings of the National Academy of Sciences. Band 104, Nr. 15, 10. April 2007, ISSN 0027-8424, S. 6261–6265, doi:10.1073/pnas.0700471104, PMID 17384150.
- Jennifer L. Troyer, Sue Vandewoude, Jill Pecon-Slattery, Carl McIntosh, Sam Franklin, Agostinho Antunes, Warren Johnson, Stephen J. O’Brien: FIV cross-species transmission: an evolutionary prospective. In: Veterinary Immunology and Immunopathology. Band 123, Nr. 1-2, 15. Mai 2008, ISSN 0165-2427, S. 159–166, doi:10.1016/j.vetimm.2008.01.023, PMID 18299153.
- Niels C. Pedersen: The feline immunodeficiency virus. In: Veterinary Immunology and Immunopathology. Band 2. N.Y: Plenum Press, Inc., 1993, ISBN 978-1-4899-1627-3, S. 181–228, doi:10.1007/978-1-4899-1627-3.
- Aymeric de Parseval, Udayan Chatterji, Peiqing Sun, John H. Elder: Feline immunodeficiency virus targets activated CD4+ T cells by using CD134 as a binding receptor. In: Proceedings of the National Academy of Sciences. Band 101, Nr. 35, 31. August 2004, ISSN 0027-8424, S. 13044–13049, doi:10.1073/pnas.0404006101, PMID 15326292.
- Masayuki Shimojima, Takayuki Miyazawa, Yasuhiro Ikeda, Elizabeth L. McMonagle, Hayley Haining, Hiroomi Akashi, Yasuhiro Takeuchi, Margaret J. Hosie, Brian J. Willett: Use of CD134 as a primary receptor by the feline immunodeficiency virus. In: Science. Band 303, Nr. 5661, 20. Februar 2004, ISSN 1095-9203, S. 1192–1195, doi:10.1126/science.1092124, PMID 14976315.
- A. de Parseval, J. H. Elder: Binding of recombinant feline immunodeficiency virus surface glycoprotein to feline cells: role of CXCR4, cell-surface heparans, and an unidentified non-CXCR4 receptor. In: Journal of Virology. Band 75, Nr. 10, 1. Mai 2001, ISSN 0022-538X, S. 4528–4539, doi:10.1128/JVI.75.10.4528-4539.2001, PMID 11312323.
- Stephen P. Dunham: Lessons from the cat: development of vaccines against lentiviruses. In: Veterinary Immunology and Immunopathology. Band 112, Nr. 1–2, 15. Juli 2006, ISSN 0165-2427, S. 67–77, doi:10.1016/j.vetimm.2006.03.013, PMID 16678276.
- Hosie MJ, Beatty JA.: Vaccine protection against feline immunodeficiency virus: setting the challenge. Aust Vet J. 2007 Jan–Feb;85(1–2):5–12; quiz 85.
- Impfstoff-Information auf den Seiten der American Association of Feline Practitioners
- E. W. Uhl, T. G. Heaton-Jones, R. Pu, J. K. Yamamoto: FIV vaccine development and its importance to veterinary and human medicine: a review FIV vaccine 2002 update and review. In: Veterinary Immunology and Immunopathology. Band 90, Nr. 3-4, 1. Dezember 2002, ISSN 0165-2427, S. 113–132, PMID 12459160.
- Nelson RW, Couto CG (Hrsg.): Innere Medizin der Kleintiere. 1. Auflage, Urban und Fischer, München 2006, ISBN 3-437-57040-4, S. 1352.
- Mary Jo Burkhard, Gregg A. Dean: Transmission and immunopathogenesis of FIV in cats as a model for HIV. In: Current HIV research. Band 1, Nr. 1, 1. Januar 2003, ISSN 1570-162X, S. 15–29, PMID 15043209.
- Dyana T. Saenz, Eric M. Poeschla: FIV: from lentivirus to lentivector. In: The Journal of Gene Medicine. 6 Suppl 1, 1. Februar 2004, ISSN 1099-498X, S. S95–104, doi:10.1002/jgm.500, PMID 14978754.
- Annette L. Litster: Transmission of feline immunodeficiency virus (FIV) among cohabiting cats in two cat rescue shelters. In: The Veterinary Journal. Band 201, Nr. 2, 1. August 2014, S. 184–188, doi:10.1016/j.tvjl.2014.02.030 (sciencedirect.com).
- Shelton, G.H., Waltier, R.M., Connor, S.C., Grant, C.K., 1989. Prevalence of felineimmunodeficiency virus and feline leukaemia virus infections in pet cats. In: Journal of the American Animal Hospital Association 25, S. 7–12.
- M.J. Burkhard, G.A. Dean: Transmission and immunopathogenesis of FIV in cats as a model for HIV. In: Current HIV Research 1, 2003. S. 15–29.
- Bishop, S.A., Stokes, C.R., Gruffydd-Jones, T.J., Whiting, C.V., Harbour, D.A., 1996. Vaginaland rectal infection of cats with feline immunodeficiency virus. In: Veterinary Microbiology 51, S. 217–227.
- Annette L. Litster: Transmission of feline immunodeficiency virus (FIV) among cohabiting cats in two cat rescue shelters. In: The Veterinary Journal. Band 201, Nr. 2, 1. August 2014, S. 184–188, doi:10.1016/j.tvjl.2014.02.030 (sciencedirect.com).
- Yamamoto, J.K., Sparger, E., Ho, E.W., Andersen, P.R., O’Connor, T.P., Mandell, C.P.,Lowenstine, L., Munn, R., Pedersen, N.C., 1988. Pathogenesis of experimentally induced feline immunodeficiency virus infection in cats. In: American Journal of Veterinary Research 49, S. 1246–1258.
- Medeiros, O., Martins, A.N., Dias, C.G., Tanuri, A., Brindeiro Rde, M., 2012. Natural transmission of feline immunodeficiency virus from infected queen to kitten. In: Journal of Virology 9, S. 99.
- Sellon, R.K., Jordan, H.L., Kennedy-Stoskopf, S., Tompkins, M.B., Tompkins, W.A., 1994. Feline immunodeficiency virus can be experimentally transmitted via milk during acute maternal infection. Journal of Virology 68, 3380–3385
- Ueland, K., Nesse, L.L., 1992. No evidence of vertical transmission of naturally acquired feline immunodeficiency virus infection. In: Veterinary Immunology and Immunopathology 33, S. 301–308.
- O’Niel, L.L., Burkhard, M.J., Hoover, E.A., 1996. Frequent perinatal transmission of feline immunodeficiency virus by chronically infected cats. In: Journal of Virology 70, S. 2894–2901.
- Sellon, R.K., Jordan, H.L., Kennedy-Stoskopf, S., Tompkins, M.B., Tompkins, W.A., 1994. Feline immunodeficiency virus can be experimentally transmitted via milk during acute maternal infection. In: Journal of Virology 68, S. 3380–3385.
- Annette L. Litster: Transmission of feline immunodeficiency virus (FIV) among cohabiting cats in two cat rescue shelters. In: The Veterinary Journal. Band 201, Nr. 2, 1. August 2014, S. 184–188, doi:10.1016/j.tvjl.2014.02.030 (sciencedirect.com).
- Pedersen NC, Yamamoto JK, Ishida T, Hansen H. Feline immunodeficiency virus infection. In: Vet Immunol Immunopathol. Mai 1989; 21(1): S. 111–29.
- Yamamoto JK, Sparger E, Ho EW, Andersen PR, O’Connor TP, Mandell CP, Lowenstine L, Munn R, Pedersen NC: Pathogenesis of experimentally induced feline immunodeficiency virus infection in cats. In: Am J Vet Res. August 1988; 49(8): S. 1246–58.
- Katrin Hartmann: Clinical Aspects of Feline Retroviruses: A Review. In: Viruses. Band 4, Nr. 11, 31. Oktober 2012, S. 2684–2710, doi:10.3390/v4112684 (mdpi.com).
- Hakimeh Mohammadi, Dorothee Bienzle: Pharmacological Inhibition of Feline Immunodeficiency Virus (FIV). In: Viruses. Band 4, Nr. 5, 27. April 2012, S. 708–724, doi:10.3390/v4050708 (mdpi.com).
Literatur
- Niels C. Pedersen: The Feline Immunodeficiency virus. In: The Retroviridae. Band 2, herausgegeben von Jay A. Levy, Plenum Press, New York 1993.
- Sue VandeWoude, Cristian Apetrei: Going wild: lessons from naturally occurring T-lymphotropic lentiviruses. In: Clinical Microbiology Reviews. Band 19, Nr. 4, 1. Oktober 2006, ISSN 0893-8512, S. 728–762, doi:10.1128/CMR.00009-06, PMID 17041142 (englisch).
- Stephen P. Dunham: Lessons from the cat: development of vaccines against lentiviruses. In: Veterinary Immunology and Immunopathology. Band 112, Nr. 1-2, 15. Juli 2006, ISSN 0165-2427, S. 67–77, doi:10.1016/j.vetimm.2006.03.013, PMID 16678276 (englisch).