Lamivudin
Lamivudin, kurz 3TC (Handelsnamen: Epivir®, Zeffix®; Hersteller: GlaxoSmithKline) ist ein Arzneistoff zur Behandlung von HIV-1-infizierten Patienten im Rahmen einer antiretroviralen Therapie (HAART) und der chronischen HBV-Infektion.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
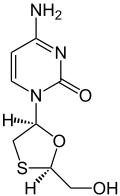 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Lamivudin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C8H11N3O3S | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis fast weißes, polymorphes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
J05AF05 | |||||||||||||||||||||
| Wirkstoffklasse |
Virustatikum, nukleosidische Reverse-Transkriptase-Inhibitoren | |||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 229,257 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Es ist ein chemisches Analogon des Nukleosids Cytidin und zählt zur Gruppe der nukleosidischen Reverse-Transkriptase-Inhibitoren (NRTI).
Geschichte
Lamivudin ist seit 1995 in Deutschland zugelassen. In der Fixkombination Kivexa mit Abacavir (ABC) ist es der derzeit zweithäufigste NRTI-Backbone einer HIV-Therapie nach Truvada (Tenofovir plus Emtricitabin).
Pharmakologie
Lamivudin wird intrazellulär in ein 5'-Triphosphat umgewandelt. So kann es, wie andere Nukleosid-Analoga, in die virale DNA eingebaut werden und führt zum Abbruch der DNA-Synthese.[4]
Pharmakokinetik
Die Bioverfügbarkeit von Lamivudin nach peroraler Gabe beträgt etwa 80 %. Die maximalen Serumkonzentrationen liegen nach üblicher Dosierung (2-mal täglich 2 mg/kg Körpergewicht) bei 1,5 bis 1,9 mg/l. Gleichzeitige Nahrungsaufnahme beeinflusst die Bioverfügbarkeit nicht signifikant. Das Verteilungsvolumen wird mit 1,3 l/kg Körpergewicht angegeben. Der Arzneistoff wird mit einer Halbwertzeit von 5 bis 7 Stunden überwiegend unverändert renal eliminiert. Die Bindung an Plasmaproteine ist gering. Bei renaler Insuffizienz (Clearance < 50 ml/min) wird eine Dosis von 150 mg nur alle 24 Stunden verabreicht; falls die Nierenfunktion in höherem Maße eingeschränkt ist, soll die Einzeldosis zunächst halbiert und dann entsprechend der individuellen Situation weiter angepasst werden.[4]
Nebenwirkungen
Nebenwirkungen, die möglicherweise im Zusammenhang mit der Behandlung auftreten, sind:[5]
Häufig: Kopfschmerzen, Schlaflosigkeit, Husten, nasale Symptome, Übelkeit, Erbrechen, Bauchschmerzen, Durchfall, Hautausschlag, Alopezie, Arthralgien, Muskelbeschwerden, Müdigkeit, Unwohlsein, Fieber
Gelegentlich: Neutropenie, Anämie, Thrombozytopenie, vorübergehende Erhöhung der Leberenzyme
Selten: Pankreatitis, Erhöhung der Serumamylase, Hepatitis, Angioödem, Rhabdomyolyse
Sehr selten: Erythroblastopenie, Laktatazidose, Periphere Neuropathie
Resistenzen
HI-Viren entwickeln bei Monotherapie relativ leicht Resistenzen gegen Lamivudin: Eine einzige Mutation im Erbgut (M184V oder M184I) genügt, um HIV gegen Lamivudin hochgradig resistent werden zu lassen. Daher muss Lamivudin zur HIV-Therapie grundsätzlich in Kombination mit mindestens einem anderen antiretroviralen Arzneistoffen gegeben werden.
Darreichungsformen
Lamivudin wird peroral verabreicht: etwa in Form von Tabletten zu 100 mg, 150 mg oder 300 mg sowie einer Lösung zum Einnehmen. Ferner gibt es fixe Kombinationen mit Zidovudin oder Abacavir.
Synthese
Für die Herstellung von Lamivudin sind mehrere Synthesevarianten bekannt.[6] Ein Syntheseweg startet mit der Umsetzung von Benzoyloxyacetaldehyd mit Mercaptoacetaldehyddimethylacetal, wobei die Oxathiolansubstruktur gebildet wird. Im zweiten Schritt erfolgt in einer nucleophilen Substitution die Umsetzung mit Cytosin. Nach einer sauren Hydrolyse wird das Racemat der Wirkstoffstruktur erhalten. Im letzten Schritt führt eine Racematspaltung zum gewünschten Stereoisomer.[6]
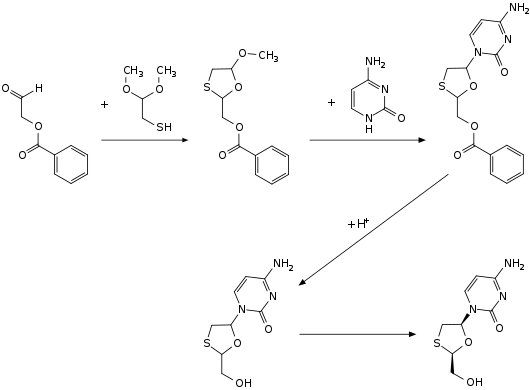
Alternative Synthesen starten von Mercaptoweinsäure, Glyoxylsäure oder Mercaptoessigsäure.[6]
Physikalische Eigenschaften
Lamivudin zeigt ein ausgeprägtes polymorphes Verhalten. Es sind drei verschiedene polymorphe Formen bekannt, wobei bei zwei Formen jeweils eine Tief- und Hochtemperaturform beschrieben werden.[7] Die drei Formen können mit einem unterschiedlichen Kristallhabitus durch Kristallisation aus verschiedenen Lösungsmitteln hergestellt werden. Die Form IL resultiert als lange Nadeln aus Lösungsmitteln wie Wasser, Methanol und 1,4-Dioxan, Form II als prismatische Kristalle aus Ethylacetat, Acetonitril, Isopropanol und Toluol und Form IIIL als feine Nadeln aus n-Heptan, 1-Butanol und Chloroform. Die thermodynamisch stabile und kommerziell verwendete Form II schmilzt bei 178,6 °C mit einer Schmelzenthalpie von 20,84 kJ·mol−1 bzw. 90,9 J·g−1.[7] Form IL wandelt sich bei 117,5 °C mit einer Umwandlungsenthalpie von −4,49 kJ·mol−1 bzw. −19,6 J·g−1 in die Form IH um, die bei 178,2 °C mit einer Schmelzenthalpie von 25,20 kJ·mol−1 bzw. 109,9 J·g−1 schmilzt. Analog wird für die Form IIIL bei 114,3 °C mit einer Umwandlungsenthalpie von −3,19 kJ·mol−1 bzw. −13,9 J·g−1 eine Umwandlung in die Form IIIH beobachtet, die bei 173,8 °C mit einer Schmelzenthalpie von 10,02 kJ·mol−1 bzw. 43,7 J·g−1 schmilzt. Aus der Irreversibilität der Phasenübergänge von Form IL zu Form IH wie auch von Form IIIL zu Form IIIH kann auf ein monotropes Verhältnis zwischen den Formen geschlossen werden. Untersuchungen zur Löslichkeit und Lösungsenthalpie identifizieren die Form II als die thermodynamisch stabile Form bei Raumtemperatur. Alle fünf Spezies können anhand ihrer Pulverdiffraktogramme unterschieden werden.[7]
Handelsnamen
3TC (CH), Epivir (D, A), Zeffix (D, CH),
Combivir (D, A, CH), Kivexa (D, A, CH), Trizivir (D, CH), Dovato (D)
Weblinks
- Europäischer öffentlicher Beurteilungsbericht (EPAR) und Produktinformation zu Zeffix auf der Website der Europäischen Arzneimittelagentur
- Kapitel 7: Antiretrovirale und wichtige Medikamente in HIV-Buch 2011. Das Buch zu HIV und AIDS.
- Kapitel 6.2: Substanzklassen, Medikamentenübersicht in HIV-Buch 2011. Das Buch zu HIV und AIDS.
Einzelnachweise
- Datenblatt LAMIVUDINE CRS (PDF) beim EDQM, abgerufen am 26. Februar 2009.
- Eintrag zu Lamivudine in der DrugBank der University of Alberta, abgerufen am 7. Juni 2021.
- Datenblatt Lamivudine bei Sigma-Aldrich, abgerufen am 7. April 2011 (PDF).
- Lamivudin, Information der Zeitschrift für Chemotherapie, aus Heft 6, 1996.
- GSK: ViiV Healthcare Fachinformation Epivir, Februar 2019, abgerufen am 10. April 2019.
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications, 4. Auflage (2001) Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.
- Renu Chadha; Poonam Arora; Swati Bhandari: Polymorphic Forms of Lamivudine: Characterization, Estimation of Transition Temperature, and Stability Studies by Thermodynamic and Spectroscopic Studies in International Scholarly Research Network, ISRN Thermodynamics 2012, Article ID 671027, doi:10.5402/2012/671027.