Fozivudintidoxil
Fozivudintidoxil (Hersteller: Heidelberg-Pharma; geplanter Handelsname: Tidoxil) ist ein experimenteller Arzneistoff zur Behandlung von HIV-infizierter Patienten im Rahmen einer HIV-Kombinationstherapie.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
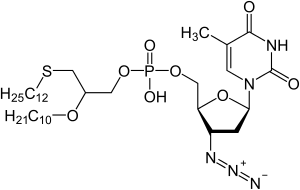 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Fozivudintidoxil | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C35H64N5O8PS | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse |
Virustatikum, nukleosidische Reverse-Transkriptase-Inhibitoren | |||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 745,95 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Der Wirkstoff gehört zur Gruppe der nukleosidischen Reverse-Transkriptase-Inhibitoren (NRTI).
Pharmakologie
Fozivudintidoxil ist ein Konjugat von Azidothymidin (AZT), das über eine Thioetherbindung mit einem Lipid verbunden ist.[2] Im Vergleich zu AZT hat Fozivudintidoxil eine mehrfach höhere Wirkung in HIV-1-infizierten CEM-SS-Zellen (eine Zelllinie). In-vitro wurden synergestische Effekte mit Proteaseinhibitoren beschrieben, wie sie auch bei anderen Inhibitoren der reversen Transkriptase vorkommen (HAART).
Pharmakokinetik
Fozivudintidoxil verteilt sich durch die Prodrug-Formierung selektiv in verschiedenen Organsystemen, insbesondere im lymphatischen Gewebe, jedoch nicht im Knochenmark. Die Konzentrationen im Blutplasma und im Liquor waren vergleichbar.
Fozivudintidoxil hat im Vergleich zu Azidothymidin eine deutlich verlängerte Halbwertszeit im Blutplasma. Dadurch ist eine einmalige tägliche Einnahme möglich.
Nebenwirkungen
Die Entwicklung des Fozivudintidoxil wurde aufgrund der Toxizität für Zellen des Knochenmarks und der Leber eingestellt.[3] In einer klinischen Phase-II-Studie beendete ein Patient aufgrund erhöhter Leberwerte die Teilnahme.[4]
Resistenzen
Über Resistenzen ist derzeit noch nichts veröffentlicht worden.
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Fozivudine: BM 211290, fozivudine tidoxil, FZT, HDP 990002, W 09726867. In: Drugs in R&D. Band 5, Nummer 1, 2004, S. 41–43, PMID 14725491.
- A. C. Venhoff, D. Lebrecht, F. U. Reuss, B. Heckl-Ostreicher, R. Wehr, U. A. Walker, N. Venhoff: Mitochondrial DNA depletion in rat liver induced by fosalvudine tidoxil, a novel nucleoside reverse transcriptase inhibitor prodrug. In: Antimicrobial agents and chemotherapy. Band 53, Nummer 7, Juli 2009, S. 2748–2751, doi:10.1128/AAC.00364-09. PMID 19433557. PMC 2704664 (freier Volltext).
- Girard PM, Pegram PS, Diquet B, Anderson R, Raffi F, Tubiana R, Sereni D, Boerner D: Phase II placebo-controlled trial of fozivudine tidoxil for HIV infection: pharmacokinetics, tolerability, and efficany. J Acquir Immune Defic Syndr. 2000 Mar 1;23(3):227–235. PMID 10839658.