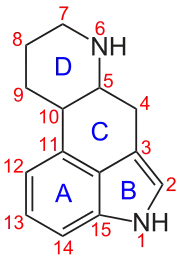
Ergoline
Ergoline (auch Ergolinderivate) sind vom Ergolin abgeleitete chemische Verbindungen. Sie kommen in der Natur in Form der Mutterkornalkaloide vor. Zu ihnen zählen die wasserlöslichen Ergine (Derivate der Lysergsäure sowie deren Amide), wasserunlösliche Ergopeptide und die Gruppe der Clavine.[1] Darüber hinaus finden zahlreiche, partialsynthetisch hergestellte Ergoline Verwendung. Durch Hydrierung in 9,10-Position von natürlich vorkommenden Mutterkornalkaloiden werden beispielsweise Dihydroergotamin und Dihydroergocryptin erhalten. Weitere wichtige Ergolinderivate zeichnen sich durch Substituenten in den Positionen N1 (z. B. bei Methysergid), N6 (z. B. bei Cabergolin) und C8 (z. B. bei Pergolid) aus. Ein als D1-Dopaminagonist wirksames 8,9-benzanelliertes Ergolin trägt die Chiffre CY-208,243. Bromocriptin ist ein am Indol in Stellung C2 bromiertes Ergolen. In den Stellungen C13 und C14 wird metabolische Hydroxylierung beobachtet.
Ergolene
Die große Mehrzahl der natürlich vorkommenden Ergoline weist eine gegenüber dem Ergolin zusätzliche Doppelbindung in 8,9- (Δ8,9-Ergolene) oder in 9,10-Position (Δ9,10-Ergolene) auf. Zu den Δ8,9-Ergolene zählen unter anderem Paspalsäure und die Clavine Agroclavin und Elymoclavin. Das weitaus größte natürlich vorkommende Substanzspektrum besitzen die Δ9,10-Ergolene. Zu ihnen zählen neben der Lysergsäure und den von ihr abgeleiteten einfachen Amiden (z. B. Ergin) zahlreiche Clavine, wie Lysergol, Penniclavin und Setoclavin, und die therapeutisch relevanten Mutterkornalkaloide vom Peptidtyp.[2] Auch einige bedeutsame partialsynthetische Ergoline, wie Lisurid, Bromocriptin und Methysergid, besitzen ein Δ9,10-Ergolengrundgerüst.[3]
Modifikationen in Position 1
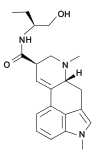 | 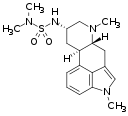 |
| Methysergid | Mesulergin |
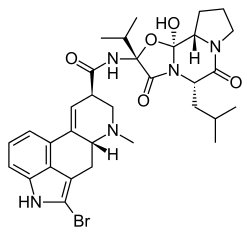 |  |
| Bromocriptin | 2-Brom-LSD |
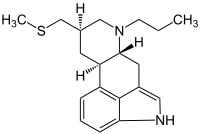 | 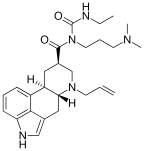 |
| Pergolid | Cabergolin |
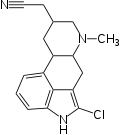 | 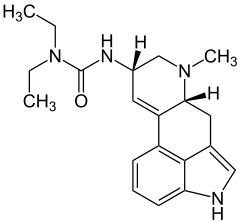 |
| Lergotril | Lisurid |
Chemische Modifikationen in N1-Position zählen zu den häufigsten durchgeführten Veränderungen am Ergolinsystem. Zum einen ist der indolische Stickstoff für Alkylierungen, Acylierungen, Mannich-Reaktionen und Michael-Additionen recht leicht zugänglich.[3] Zum anderen weckten tierexperimentelle Befunde an Nagetiermodellen die Hoffnung, dass sich durch N1-Alkylierung die pharmakologische Selektivität der Ergoline zu Gunsten der Serotoninrezeptoren steigern und so das Nutzen-Risiko-Profil potenzieller Therapeutika mit Ergolinstruktur verbessern ließe.[4][5] Später stellte sich jedoch die beobachtete pharmakologische Selektivität als ein auf Nagetiere beschränktes Phänomen heraus.[6][7] Von den N1-modifizierten Ergolinen erlangten lediglich Methysergid in der Behandlung der Migräne und Nicergolin zur Behandlung seniler Hirnleistungsstörungen therapeutische Bedeutung in der Humanmedizin. Darüber hinaus wird Metergolin in der Tierheilkunde genutzt. Weitere Vertreter dieser Stoffgruppe sind unter anderem Amesergid, Sergolexol und Mesulergin.
Modifikationen in Position 2
Bis auf wenige Ausnahmen sind alle natürlichen Ergoline unsubstituiert. Eine markante Ausnahme ist das Fumigaclavin C aus Aspergillus fumigatus, welches aus dem in Position 2 unsubstituierten Fumigaclavin A und Dimethylallylpyrophosphat gebildet wird.[8]
Chemisch ist die Position 2 im Ergolingrundgerüst gut für elektrophile und radikalische Substitutionsreaktionen zugänglich. Neben halogenierten Ergolinen wurden unter anderem 2-Aminoergoline und 2-Acylergoline beschrieben.[3] Das in Position 2 bromierte Bromocriptin wird in der Therapie der Parkinson-Krankheit, der Amenorrhö, der Akromegalie und zur Hemmung der Prolaktinsekretion eingesetzt. Auch Lergotril erwies sich in klinischen Studien zur Behandlung der Parkinson-Krankheit als wirksam, besitzt aber ein zu ungünstiges Nebenwirkungsspektrum für ein Therapeutikum.[9] Das radioaktiv markierbare 2-Brom-LSD ist ein wichtiges Werkzeug in der experimentellen Pharmakologie.
Modifikationen in Position 6
Alle natürlich vorkommenden Ergolinalkaloide sind an der N6-Position methyliert. Mit Hilfe des Von-Braun-Abbaus unter Verwendung von Bromcyan lassen sich die entsprechenden demethylierten Ergolinderivate darstellen. Ein Austausch der N6-Methylgruppe gegen längerkettige Alkylreste führt zu einer Steigerung der Wirkpotenz an Dopaminrezeptoren.[10] Insbesondere Propyl- und Allyl-substituierte Ergoline haben sich als besonders wirksam herausgestellt. Mit Pergolid und Cabergolin wurden zwei Vertreter der N6-substituierten Ergoline in der Therapie der Parkinson-Krankheit eingesetzt.
Modifikationen in Position 8
Ein besonders breites Spektrum weisen die Substituenten in Position 8 des Ergolinsystems auf. Da diese Position im Ergolinsystem prochiral ist, kann stereochemisch zwischen 8α- und 8β-substituierten Ergolinen unterschieden werden. Entsprechend der Substituenten in Position 8 werden die natürlich vorkommenden Ergoline, die Mutterkornalkaloide, in unterschiedliche Gruppen eingeteilt. Zu ihnen zählen die tetrazyklischen Vertreter der Clavinalkaloide, die Lysergsäuren und deren einfachen Amide sowie die Mutterkornalkaloide vom Peptidtyp, einschließlich der Ergopeptine.
Das Spektrum für Substituenten in Position 8 ist bei teil- oder vollsynthetisch entwickelten Ergolinen nochmals erweitert. Im einfachsten Fall kann die Amidgruppe eines natürlichen Ergolins ausgetauscht werden. So tragen Nicergolin, Sergolexol und das in der Veterinärmedizin genutzte Metergolin in Position 8β einen Carbaminsäureestersubstituenten und das Antiparkinsonmittel Pergolid eine Methylthiomethylgruppe. Auch 8β-Hydoxy- und 8β-Aminoergoline sind beschrieben. Ausgehend vom Lysergol lässt sich mit Hilfe von Kaliumcyanid die Kettenlänge des Substituenten schrittweise verlängern. So trägt Lergotril in Position 8 eine C2 anstelle einer C1-Gruppe. Zu den in Position 8 partialsynthetisch veränderten Ergolinen zählt auch das Psychedelikum LSD, das Diethylamid der Lysergsäure. Im Gegensatz zu allen anderen pharmakologisch relevanten Ergolinen weisen die Ergolinylharnstoffderviate Lisurid und Tergurid sowie Mesulergin eine 8α-Konfiguration auf. Durch C8-Epimerisierung können zwar auch die 8β-konfigurierten Ergopeptine in die 8α-konfigurierten Ergopeptinine umgewandelt werden, diese besitzen jedoch keine therapeutische Bedeutung.
Modifikationen in Position 9
Aspergillus-Arten, insbesondere Aspergillus fumigatus, sind Produzenten von Clavinen mit einem Hydroxy- oder Alkoxysubstituenten in Position 9 des Ergolinsystems.[8] Diese als Fumigaclavine bezeichneten Alkaloide besitzen eine antimikrobielle Wirkung.[11]
Modifikationen in Position 10
Ein Substituent in Position 10 des Ergolingrundgerüsts kann durch Additions- oder Substitutionsreaktionen eingeführt werden. Unter Lichteinfluss erfolgt in wässriger Lösung eine Addition von Wasser an die Doppelbindung von Δ9,10-Ergolenen zu sogenannten Lumi-Ergolinen. Auf diese Weise lassen sich auch 10-Alkoxyergoline aus einer alkoholischen Lösung von Δ9,10-Ergolenen darstellen. Ein größeres Spektrum an Substituenten in Position 10 ermöglicht eine elektrophile Substitution unter Verwendung von Butyl-Lithium.[12] Zu den in Position 10 modifizierten Ergolinen zählt unter anderem Nicergolin.
Gerüstmodifikationen
Gerüstmodifikationen beziehen sich sowohl auf den Austausch von Gerüstatomen gegen andere Atome, meistens Heteroatome, als auch auf Veränderungen der Gliederzahl der Ringe A bis D. Zahlreiche solcherart modifizierter Substanzen sind beschrieben worden. Die Benennung gehorcht den allgemeinen Regeln der chemischen Nomenklatur. Beim Atomaustausch wird die Austauschposition vorangestellt und das Austauschatom mit Affix benannt, also mit aza (X→N), oxa (X→O), thia (X→S), carba (X→C) oder deaza (N→C), wobei hier X für ein beliebiges Gerüstatom steht. Beispiel: 1-Oxa-2-azaergolin.
Die in der Natur vorkommenden bi- oder trizyklischen Secoergoline sind Vorstufen der tetrazyklischen Ergolinalkaloide. Bei den Clavinen Dimethylallyltryptophan und N-Dimethylallyltryptophan sind die Ringe C und D geöffnet. Zu den C-Ring-geschlossenen Clavinen zählen die Chanoclavine und Paliclavin. Durch einen alternativen Ringschluss wird die Clavipitsäure mit einem Tetrahydro-1H-azepino[5,4,3-cd]indol-Grundgerüst gebildet. Secoergoline besitzen eine vergleichsweise geringe biologische Aktivität.
Durch synthetische Modifikation des Ergolingrundgerüsts konnte festgestellt werden, dass eine intakte Indolpartialstruktur für die pharmakologische Wirkung essenziell ist. Kornfeld und Mitarbeiter beschrieben im Jahr 1980 die Synthese von indazolischen 2-Azaergolinen. Sie kamen zu dem Schluss, dass die von ihnen untersuchten 2-Aza-Clavine die klassischen Wirkungen der indolischen Pendants einbüßten.[13] Durch oxidative Öffnung des Indolrings mittels Natriumperiodat können natürliche Ergoline elegant zu Hydrochinolino[5,6-ef]chinazolin-, Benzofuro[4,3-fg]hydrochinolin- und Benzisoxazolo[4,3-fg]hydrochinolin-Analoga derivatisiert werden. Zur Gewinnung der sauerstoffhaltigen Heterocyclen werden die intermediären Aniline diazotiert und schonend zu Phenolen hydrolysiert (vergl. Verkochung).[14] In der Fachliteratur bekannt sind ferner Nor-6-carba-lysergsäure, in der sich in Position 6 anstelle eines Aminstickstoffs eine Methylengruppe befindet,[15] sowie Verbindungen, in denen der Aminstickstoff der Stammverbindung formal in die Positionen 7[16], 8[17] und 9[18] verschoben ist. Ein alternativer biosynthetischer Ringschluss im Ring D führt zu dem natürlich vorkommenden 8-Oxaergolin Paspaclavin.[19]
Während eine Ringerweiterung in Ring D bisher unbekannt ist, wurde die Verengung dieses Rings, die zur Bezeichnung D-Norergolin führt, verwirklicht,[20] unter anderem in Form von D-Nor-LSD.[21] Eine formale Gerüstumlagerung, die die Ringe C und D betrifft, ist in Form von 5(10→9)Abeo-Ergolinen beschrieben worden. Einige Vertreter dieser Verbindungen wurden charakterisiert als hochpotente und selektive 5-HT1A-Rezeptoragonisten.[22]
Einzelnachweise
- Schardl CL, Panaccione DG, Tudzynski P: Ergot alkaloids – biology and molecular biology. In: The Alkaloids: Chemistry and Biology. 63, 2006, S. 45–86. doi:10.1016/S1099-4831(06)63002-2. PMID 17133714.
- Martin Buchta, Ladislav Cvak: Ergot alkaloids and other metabolites of the genus Claviceps. In: Vladimir Kren, Ladislav Cvak (Hrsg.): Ergot: The Genus Claviceps. Medicinal and Aromatic Plants - Industrial Profiles. CRC Press, 2004, ISBN 0203304195, S. 173–201.
- Petr Bulej, Ladislav Cvak: Chemical modifications of ergot alkaloids. In: Vladimir Kren, Ladislav Cvak (Hrsg.): Ergot: The Genus Claviceps. Medicinal and Aromatic Plants - Industrial Profiles. CRC Press, 2004, ISBN 0203304195, S. 202–230.
- Cohen ML, Kurz KD, Mason NR, Fuller RW, Marzoni GP, Garbrecht WL: Pharmacological activity of the isomers of LY53857, potent and selective 5-HT2 receptor antagonists. In: J Pharmacol Exp Ther. 235, Nr. 2, 1985, S. 319–323. PMID 4057073.
- Cohen ML, Fuller RW, Kurz KD, Parli CJ, Mason NR, Meyers DB, Smallwood JK, Toomey RE: Preclinical pharmacology of a new serotonergic receptor antagonist, LY281067. In: J Pharmacol Exp Ther. 244, Nr. 1, 1988, S. 106–112. PMID 3335993.
- Kao HT, Adham N, Olsen MA, Weinshank RL, Branchek TA, Hartig PR: Site-directed mutagenesis of a single residue changes the binding properties of the serotonin 5-HT2 receptor from a human to a rat pharmacology. In: FEBS Lett. 307, Nr. 3, 1992, S. 324–328. PMID 1644189.
- Johnson MP, Loncharich RJ, Baez M, Nelson DL: Species variations in transmembrane region V of the 5-hydroxytryptamine type 2A receptor alter the structure-activity relationship of certain ergolines and tryptamines. In: Mol Pharmacol. 45, Nr. 2, 1994, S. 277–286. PMID 8114677.
- Cole RJ, Kirksey JW, Dorner JW, Wilson DM, Johnson J Jr, Bedell D, Springer JP, Chexal KK, Clardy J, Cox RH: Mycotoxins produced by Aspergillus fumigatus isolated from silage. In: Ann Nutr Aliment. 31, Nr. 4–6, 1977, S. 685–691. PMID 350117.
- Lieberman AN, Gopinathan G, Estey E, Kupersmith M, Goodgold A, Goldstein M: Lergotrile in Parkinson disease: further studies. In: Neurology. 29, Nr. 2, 1979, S. 267–272. PMID 34808.
- Crider AM, Robinson JM, Floss HG, Cassady JM, Clemens JA: Ergot alkaloids. Synthesis of 6-alkyl-8-ergolenes and 6-methyl-8-aminoergolines as potential prolactin inhibitors. In: J Med Chem. 20, Nr. 11, 1977, S. 1473–1477. PMID 915908.
- Pinheiro EA, Carvalho JM, Dos Santos DC, Feitosa Ade O, Marinho PS, Guilhon GM, de Souza AD, da Silva FM, Marinho AM: Antibacterial activity of alkaloids produced by endophytic fungus Aspergillus sp. EJC08 isolated from medical plant Bauhinia guianensis. In: Natural Product Research. 27, Nr. 18, 2013, S. 1633–1638. doi:10.1080/14786419.2012.750316. PMID 23234304.
- Timms GH, Tupper DE, Morgan SE: Synthesis of novel 8- and 10-substituted clavine derivatives. In: J. Chem. Soc., Perkin Trans. 1, 1989, S. 817–822. doi:10.1039/P19890000817.
- Bach NJ et al. (1980): J. Med. Chem., S. 492.
- Mategani S (2001): J. Heterocycl. Chem., S. 759.
- Rastogi S. (1970): Indian J. Chem., S. 377.
- Horwell DC, Tupper DE, Hunter WH (1983): J . Chem. Soc. Perkin Trans. I, S. 1545.
- Hunter WH, Tupper DE (1987): J . Chem. Soc. Perkin Trans. I, S. 707.
- Stamos IK et al. (1995): J. Heterocycl. Chem., S. 1303.
- Tscherter H, Hauth H: Drei neue Mutterkornalkaloide aus saprophytischen Kulturen von Claviceps paspali Stevens et Hall. 77. Mitteilung über Mutterkornalkaloide. In: Helvetica Chimica Acta. 57, Nr. 1, 1974, S. 113–121. doi:10.1002/hlca.19740570111.
- Inzce M et al. (2008): Tetrahedron, S. 2924.
- Hunter WH (1986): Brit. UK Pat. Appl., GB 2162182 A 19860129.
- Mantegani S, Brambilla E, Varasi M: Ergoline derivatives: receptor affinity and selectivity. In: Farmaco. 30, Nr. 5, 1999, S. 288–296. PMID 10418123.