Ammoniumthiocyanat
Ammoniumthiocyanat (veraltet: Ammoniumrhodanid) ist das Ammoniumsalz der Thiocyanwasserstoffsäure (veraltet: Rhodanwasserstoffsäure, HSCN) mit der Formel NH4SCN.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
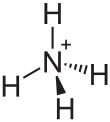 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumthiocyanat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | NH4SCN | |||||||||||||||
| Kurzbeschreibung |
farblose, hygroskopische, monokline Tafeln oder Blättchen; Durch Lagerung an der Luft können verschiedene Färbungen auftreten[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 76,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,3 g·cm−3 (20 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung: 170 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
sehr leicht in Wasser (1600 g·l−1 bei 20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften
Ammoniumthiocyanat bildet farb- und geruchlose, hygroskopische, in Wasser und Ethanol leicht lösliche Kristalle mit einer Dichte von 1,3 g/cm3.
Herstellung
Ammoniumthiocyanat kann aus Schwefelkohlenstoff und Ammoniak unter Druck und erhöhter Temperatur hergestellt werden:
Verwendung
Verwendet wird es als Stabilisator für fotografische Entwickler, als Vulkanisationsbeschleuniger, als Beschleuniger für Mörtel und Beton und in Herbiziden.
In der analytischen Chemie dient es als Nachweisreagenz von Eisen(III)-Ionen. Die sehr intensive rote Farbe in wässriger Lösung ist auf das Vorhandensein von undissoziiertem [Fe(SCN)3(H2O)3] neben den Ionen [Fe(SCN)2(H2O)4]+ und [Fe(SCN)(H2O)5]2+ zurückzuführen.
Eigenschaften
Es lagert sich ab einer Temperatur von 70 °C teilweise in Thioharnstoff um, analog zur Wöhlerschen Harnstoffsynthese aus Ammoniumcyanat. Durch Einengen einer wässrigen Lösung lässt sich Thioharnstoff gewinnen.

Sicherheitshinweise
Ammoniumthiocyanat wurde 2013 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit und die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Ammoniumthiocyanat waren Besorgnisse bezüglich hoher (aggregierter) Tonnage, hohem Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Substanzen sowie als potenzieller endokriner Disruptor. Die Neubewertung führte Tschechien ab 2015 durch. Der Abschlussbericht ergab keine Notwendigkeit für EU-weite regulatorische Maßnahmen.[5][6]
Einzelnachweise
- Eintrag zu AMMONIUM THIOCYANATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. November 2021.
- Eintrag zu Ammoniumthiocyanat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Mai 2014.
- Datenblatt Ammoniumthiocyanat (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu Ammoniumthiocyanat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Ammonium thiocyanate, abgerufen am 26. März 2019.

