Borazin
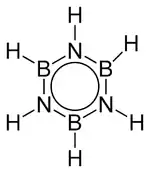
Borazin (Cyclotriborazan) ist eine cyclische Verbindung aus Bor, Stickstoff und Wasserstoff mit der Summenformel B3H6N3. Borazin ist isoelektronisch zu Benzol, die Frage der Aromatizität der Verbindung ist jedoch kritisch zu diskutieren. Nach einem Vorschlag von Nils Wiberg wird der Grundkörper dieser Verbindungen auch als „anorganisches Benzol“ bezeichnet. Daraus leitet sich auch die systematisch nicht zulässige Bezeichnung Borazol ab.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Borazin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | B3H6N3 | ||||||||||||||||||
| Kurzbeschreibung |
klare, farblose Flüssigkeit mit einem aromatischen Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 80,53 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,83 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
55,0 °C[2] | ||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−541,0 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Borazin wurde zuerst von Alfred Stock am Anfang des 20. Jahrhunderts hergestellt. Er gewann es durch Erhitzen von Diboran und Ammoniak.
Gewinnung und Darstellung
Borazin lässt sich durch Erhitzen eines Gemisches aus Diboran und Ammoniak im Molverhältnis 1:2 auf 250–300 °C herstellen. Die Ausbeute dieser chemischen Reaktion liegt bei 50 %:
Alternativ sind als Edukte auch Lithiumborhydrid und Ammoniumchlorid verwendbar, was zu einer höheren Ausbeute führt:
Man kann statt Lithiumborhydrid auch Natriumborhydrid verwenden:
Eine weitere Borazinsynthese ist folgende zweistufige:[5]
Das synthetisierte Borazin wird anschließend per Destillation aufkonzentriert.
Eigenschaften
In Wasser zersetzt sich Borazin zu Borsäure, Ammoniak und Wasserstoff. Borazin (Bildungsenthalpie ΔHf = −531 kJ/mol) ist thermisch sehr beständig.
Struktur
Borazin ist isoster zu Benzol. Das heißt, die Bindungen und Bindungsverhältnisse stimmen mit denen im Benzol überein oder ähneln sich sehr stark. Der C-C-Abstand im Benzol liegt bei 139,7 pm. Die Bindungslänge zwischen Bor und Stickstoff beträgt im Borazin 143,6 pm. Damit liegt er erwartungsgemäß zwischen dem Wert für eine B-N-Einfachbindung (151 pm), wie man sie im Bornitrid vorfindet, und dem für eine B=N-Doppelbindung (131 pm).
Mesomerie
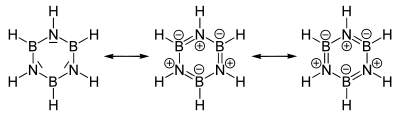
Der Elektronegativitätsunterschied zwischen Bor (2,04 nach Pauling-Skala) und Stickstoff (3,04) sowie der Elektronenmangel am Bor-Atom und das freie Elektronenpaar beim Stickstoff begünstigen die Ausbildung Mesomerer der Borazin-Struktur. Bor spielt hierbei die Rolle einer Lewis-Säure, Stickstoff die einer Lewis-Base.
Reaktionen
Aufgrund der Verschiedenheit der Atome und damit der Polarität der B–N-Bindungen ist Borazin chemisch wesentlich reaktiver als Benzol. So reagiert Borazin leicht mit polaren Verbindungen wie Chlorwasserstoff, Wasser und Methanol. Chlorwasserstoff reagiert in einer Additionsreaktion mit Borazin. Mit Benzol würde diese Reaktion nicht stattfinden. Die Umsetzung mit Brom benötigt keinen Katalysator.
Aromatizität
Als Kriterien der Aromatizität werden in der Regel geometrische (Bindungslängenausgleich), magnetische (magnetische Suszeptibilität und deren Anisotropie, Ringstromeffekte, NMR-Abschirmungen) und vor allem energetische Eigenschaften (aromatische Stabilisierungsenergie und damit verbundenes, ungewöhnliches chemisches Verhalten) herangezogen.[6] Grenzfälle sind dahingehend schwierig zu beurteilen, da die einzelnen Kriterien nicht immer positiv miteinander korrelieren und keine festen Grenzen für die Beurteilung aromatisch/nicht-aromatisch definiert sind. Üblicherweise wird daher die Frage der Aromatizität anhand von Vergleichsbeispielen diskutiert, wobei Benzol in vielen Fällen als unbestrittene Referenz dient.
Gegenüber Benzol ist Borazin durch eine ungleichmäßige π-Elektronenverteilung charakterisiert (Elektronegativitätsdifferenz Bor/Stickstoff, Anhäufung von Elektronendichte am Stickstoff). Während das freie Borazin sich noch durch planare Struktur mit ausgeglichenen Bindungslängen auszeichnet, sind Tricarbonyl-Chrom-Komplexe im Gegensatz zu den Benzol-Analoga nicht mehr planar (bevorzugte Koordination über die Stickstoffe im Borazin).[7] Auf B3LYP/6-31G* berechnete aromatische Stabilisierungsenergien (ASE), magnetic susceptibility exaltation (Λ)[8] und NICS-Werte (nucleus independent chemical shift)[9] von Borazin ergeben gegenüber Benzol deutlich verringerte Werte, nichtsdestotrotz ist gerade die ASE immer noch grob halb so groß wie im Falle der eindeutig aromatischen Referenz.[10]
| ASE | Λ | NICS | |
|---|---|---|---|
| Benzol | 175,4 kJ/mol | −16,7 | −11,5 |
| Borazin | 40,2 kJ/mol | −5,9 | −2.1 |
Genauere Untersuchungen der magnetischen Eigenschaften von Borazin belegen deren komplexe Topologie, wodurch die vereinfachte Diskussion anhand von Λ- und NICS-Werten an Aussagekraft verliert, und schreiben Borazin anhand der magnetischen Eigenschaften π-Aromatizität, jedoch keinen „globalen“ aromatischen Charakter zu.[11] Die cyclische Elektronendelokalisation wird von den Autoren als „nicht-effektiv“ beschrieben. Reaktionen in der Gasphase zeigen Ähnlichkeit mit dem für Benzol typischen Reaktionsmuster der elektrophilen Substitution.[12]
Die Diskussion über den aromatischen Charakter von Borazin scheint derzeit in Fachkreisen noch nicht abgeschlossen zu sein, in der Grundtendenz wird dem Borazin jedoch ein gewisser, wenn auch gegenüber Benzol deutlich reduzierter, aromatischer Charakter zugesprochen.
Verwendung
Borazin und seine Derivate sind von Interesse als potentielle Vorläuferprodukte auf dem Weg zu Bornitrid-Keramiken. Gemischt Amino-nitro substituierte Borazine versprechen nach neueren Berechnungen deutlich höhere Detonationsgeschwindigkeit, Detonationsdruck und Gurney-Energie als herkömmliche Explosivstoffe wie z. B. CL-20.[13]
Quellen
- Eintrag zu Borazine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1116.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 1,3,5,2,4,6-triazatriborinane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 19. Juli 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-6.
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 548–549, ISBN 3-342-00280-8.
- Paul von Ragué Schleyer, Haijun Jiao: What is Aromaticity? In: Pure and Applied Chemistry. Bd. 68, Nr. 2, 1996, S. 209–218, doi:10.1351/pac199668020209.
- Gottfried Huttner, Bernhard Krieg: Kristall- und Molekülstruktur von Tricarbonyl(hexaäthylborazin)chrom(0). In: Chemische Berichte. Bd. 105, Nr. 10, 1972, S. 3437–3444, doi:10.1002/cber.19721051031.
- Hyp J. Dauben Jr., James Dennis Wilson, John L. Laity: Diamagnetic Susceptibility Exaltation as a Criterion of Aromaticity. In: Journal of the American Chemical Society. Bd. 90, Nr. 3, 1968, S. 811–813, doi:10.1021/ja01005a059.
- Paul von Ragué Schleyer, Christoph Maerker, Alk Dransfeld, Haijun Jiao, Nicolaas J. R. van Eikema Hommes: Nucleus-Independent Chemical Shifts: A Simple and Efficient Aromaticity Probe. In: Journal of the American Chemical Society. Bd. 118, Nr. 26, 1996, S. 6317–6318, doi:10.1021/ja960582d.
- Eluvathingal D. Jemmis, Boggavarapu Kiran: Aromaticity in X3Y3H6 (X = B, Al, Ga; Y = N, P, As), X3Z3H3 (Z = O, S, Se), and Phosphazenes. Theoretical Study of the Structures, Energetics, and Magnetic Properties. In: Inorganic Chemistry. Bd. 37, Nr. 9, 1998, S. 2110–2116, doi:10.1021/ic970737y.
- Rafael Islas, Eduardo Chamorro, Juvencio Robles, Thomas Heine, Juan C. Santos, Gabriel Merino: Borazine: to be or not to be aromatic. In: Structural Chemistry. Bd. 18, Nr. 6, 2007, S. 833–839, doi:10.1007/s11224-007-9229-z.
- Barbara Chiavarino, Maria Elisa Crestoni, Annito Di Marzio, Simonetta Fornarini, Marzio Rosi: Gas-Phase Ion Chemistry of Borazne, an Inorganic Analogue of Benzene. In: Journal of the American Chemical Society. Bd. 121, Nr. 48, 1999, 11204–11210, doi:10.1021/ja992220m.
- Ernst-Christian Koch, Thomas M. Klapötke: Boron-Based High Explosives. In: Propellants, Explosives, Pyrotechnics. Bd. 37, Nr. 3, 2012, S. 335–344, doi:10.1002/prep.201100157.

