Bis(trimethylsilyl)carbodiimid
Bis(trimethylsilyl)carbodiimid ist ein Carbodimid, bei dem beide Wasserstoffatome der instabilen Stammverbindung Carbodiimid HN=C=NH durch Trimethylsilylgruppen ersetzt sind. BTSC ist ein hochreaktives Äquivalent für Cyanamid und eignet sich zur Synthese von Wirk- und Farbstoffen, die eine Cyanimino-Gruppe =N-CN enthalten, zur einfachen Darstellung von Amidinen und von technischen Keramiken auf Basis von Siliciumnitriden.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
carbodiimide_Structural_formula_V1.svg.png.webp) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bis(trimethylsilyl)carbodiimid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C7H18N2Si2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 186,40 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
−24 °C bis −23 °C[2] | |||||||||||||||
| Siedepunkt |
164 °C[2] | |||||||||||||||
| Löslichkeit |
mischbar mit Diethylether, 1,4-Dioxan, Benzin, Benzol und Tetrachlormethan[2] | |||||||||||||||
| Brechungsindex |
1,4251 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Die Synthese von Bis(trimethylsilyl)carbodiimid wurde erstmals 1962 aus dem Arbeitskreis von Ulrich Wannagat berichtet.[3][2] Mehrere Synthesevarianten wurden dabei bearbeitet, wie z. B.
- Bis-trimethylsilyl-harnstoff Me3SiNHCONHSiMe3 + Phenyllithium C6H5Li + Trimethylchlorsilan Me3SiCl (Ausbeute > 80 %)
- Bis-trimethylsilyl-harnstoff + Natriumamid NaNH2 + Trimethylchlorsilan (Ausbeute 12 %)
- Natrium-bis-trimethylsilyl-amid (Me3Si)2NNa + Phosgen COCl2 (Ausbeute 60 %)
- Natrium-bis-trimethylsilyl-amid + Siliciumtetraisocyanat Si(NCO)4 (Ausbeute 20 %)
- Disilbercyanamid Ag2CN2 + Trimethylchlorsilan (Ausbeute 90 %)
die teils gute Ausbeuten liefern, aber teure oder unangenehm zu handhabende Reagentien erfordern.
Eine weitere Variante – die Entschwefelung von Bis-trimethylsilyl-thioharnstoff mit Silber-imidazol – stellt mit 51 % Ausbeute keine Verbesserung dar, während aus Cyanamid und Trichlormethylsilan in Gegenwart von Triethylamin Bis(trimethylsilyl)carbodiimid in 81%iger Ausbeute erhalten wurde.[4]
Mit Trimethylsilylcyanid reagiert Cyanamid innerhalb einer Minute in 90%iger Ausbeute zu BTSC.[5]
Ein technisches Verfahren setzt Hexamethyldisilazan mit Cyanamid bei Raumtemperatur zu BTSC in 90%iger Ausbeute und hoher Reinheit (99,5 %) um und scheint die aussichtsreichste Synthesevariante zu sein.[6]
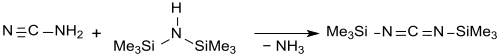
Eigenschaften
Bis(trimethylsilyl)carbodiimid ist eine bei Raumtemperatur stabile, aber entzündliche, klare und farblose Flüssigkeit, die durch Wasser unter Spaltung der Si-N-Bindung und Bildung von Hexamethyldisiloxan und Cyanamid zersetzt wird. Im Gegensatz zu organischen Diimiden reagiert BTSC nicht mit Schwefelwasserstoff H2S, Ammoniak NH3 oder Anilin.[2] Die Verbindung ist mit vielen organischen Lösungsmitteln mischbar.
Anwendungen
Bis(trimethylsilyl)carbodiimid lässt sich im Gegensatz zu organischen Diiminen, wie insbesondere Dicyclohexylcarbodiimid nicht zur Synthese von Amiden oder Estern durch Wasserabspaltung verwenden.
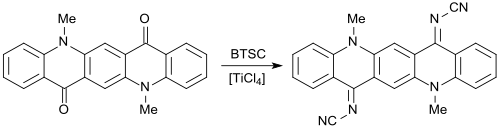
Mit Bis(trimethylsilyl)carbodiimid lassen sich Carbonylgruppen C=O in Cyaniminogruppen N-CN überführen. Wie aus dem Arbeitskreis von Siegfried Hünig erstmals 1984 berichtet, entstehen aus (substituierten) 1,4-Benzochinonen starke Elektronenakzeptoren,[7] die in Analogie mit Tetracyanochinodimethan TCNQ mit Elektronendonatoren, wie z. B. Tetrathiafulvalen TTF Charge-Transfer-Komplexe bilden, die supraleitende Eigenschaften besitzen.
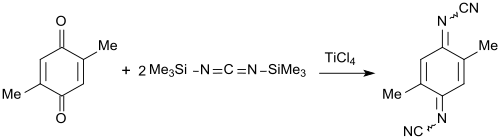
Die Cyaniminogruppe ist in ihrem elektrochemischen Verhalten mit dem der räumlich größeren Dicyanomethylengruppe weitgehend identisch. Sie kann sperrigen Substituenten besser ausweichen und die für die Ausbildung von CT-Komplexen wichtige planare Struktur besser aufrechterhalten.[8]
Die Standardverbindung TCNQ kann mittels TMSCN aus Terephthalsäuredichlorid in Gegenwart von Pyridin über das silylierte Benzolderivat und anschließende Reaktion mit Phosphoroxychlorid in einer Gesamtausbeute von ca. 60 % erhalten werden.[9]
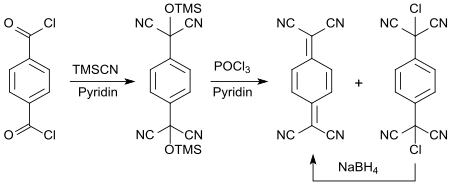
Auch hybride Elektronenakzeptoren mit Dicyanmethylen- und Cyaniminogruppen wurden beschrieben, die als gelbe Feststoffe mit dem orangefarbenen TTF grüne CT-Komplexe bilden.[10]
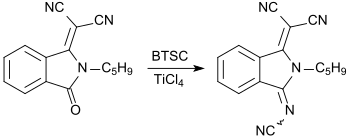
Bei dem Austausch von Ketonfunktionen durch Cyaniminogruppen in Pigmente, wie z. B. Chinacridon-Pigmente, werden Fluoreszenzfarbstoffe erhalten.[11]
Unlängst wurde die direkte Einführung einer Carboxamidin-Funktion -CO(NH)NH2 in aliphatische und aromatische Grignard-Verbindungen berichtet.[12]
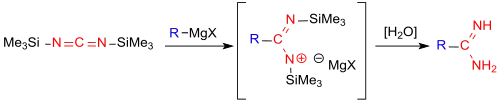
Die Reaktion mit Bis(trimethylsilyl)carbodiimid vermeidet die mehrstufige Darstellung der Iminoestersalze aus Nitrilen und Alkoholen (Pinner-Salze) und deren Umsetzung mit Ammoniak bei der Pinner-Reaktion. Allerdings sind die in hohen Ausbeuten über das neue Verfahren zugänglichen Amidinsalze mit Magnesiumhalogeniden verunreinigt, die nur unter hohen Ausbeuteverlusten abgetrennt werden können.
Durch chemische Gasphasenabscheidung lassen sich mit Bis(trimethylsilyl)carbodiimid keramische Si-C-N-Filme auf Stahloberflächen – z. B. zur Härtung von Schneidwerkzeugen – erzeugen, die sich zwar als außerordentlich korrosionsbeständig, aber auch als brüchig und schlecht haftend herausstellten.[13]
Literatur
Henri Ulrich: Chemistry and Technology of Carbodiimides. Wiley-VCH, Weinheim 2007, ISBN 978-0-470-06510-5.
Einzelnachweise
- Datenblatt Bis(trimethylsilyl)carbodiimide bei Sigma-Aldrich, abgerufen am 3. Juli 2018 (PDF).
- J. Pump, U. Wannagat: Beiträge zur Chemie der Silicium-Stickstoff-Verbindungen, XIV, Bis-Trimethylsilyl-Carbodiimid. In: Justus Liebigs Ann. Chem. Band 652, Nr. 1, 1962, S. 21–27, doi:10.1002/jlac.19626520104.
- J. Pump, U. Wannagat: Bis-(trimethylsilyl)-carbodiimid. In: Angew. Chem. Band 74, Nr. 3, 1962, S. 117–117, doi:10.1002/ange.19620740308.
- L. Birkofer, A. Ritter, P. Richter: N,N‘-Bis-trimethylsilyl-carbodiimid. In: Tetrahedron Lett. Band 3, Nr. 5, 1962, S. 195–198, doi:10.1016/S0040-4039(00)70856-2.
- K. Mai, G. Patil: An expedient synthesis of bis(trimethylsilyl)carbodiimide. In: J. Org. Chem. Band 52, Nr. 2, 1987, S. 275–276, doi:10.1021/jo00378a020.
- Patent DE19822281C1: Verfahren zur Herstellung von Bis-trimethylsilyl-carbodiimid. Angemeldet am 18. Mai 1998, veröffentlicht am 19. August 1999, Anmelder: SKW Trostberg AG, Erfinder: T. Güthner, H. Krommer.
- A. Aumüller, S. Hünig: Einstufiger Weg zu N‐Cyaniminen und zu N,N′‐Dicyanchinondiiminen, einer neuen Klasse von Elektronenacceptoren. In: Angew. Chem. Band 96, Nr. 6, 1984, S. 437–438, doi:10.1002/ange.19840960620.
- A. Aumüller, S. Hünig: Multistep Reversible Redox Systems, XLVI1)N,N′‐Dicyanoquinonediimines – A New Class of Compounds, I: Synthesis and General Properties. In: Justus Liebigs Ann. Chem. Band 142, 1986, S. 142–164, doi:10.1002/jlac.198619860114.
- S. Yamaguchi, T. Hanafusa: Preparation of 7,7,8,8-tetracyanoquinodimethane and its derivatives. In: Chem. Lett. Band 14, Nr. 6, 1985, S. 689–690, doi:10.1246/cl.1985.689.
- Synthesis of heterocyclic analogues of Benzo-TCQN. In: Ph.D. Thesis. Dublin City University, Juli 2002, abgerufen am 16. Juli 2018.
- Patent EP0673979B1: Cyanoiminogruppen enthaltende Fluoreszenzfarbstoffe. Angemeldet am 16. März 1999, veröffentlicht am 30. August 2000, Anmelder: Ciba Specialty Chemicals Holding Inc., Erfinder: J.S. Zambounis, Z. Hao, A. Iqbal.
- T. Güthner, E. Huber, J. Sans, F. Thalhammer: Direct introduction of an N,N‘-nonsubstituted carboxamidine group by Grignard addition to silylated cyanamide. In: Synlett. Band 28, Nr. 12, 2017, S. 1437–1440, doi:10.1055/s-0036-1589000.
- Y. Zhou et al.: Hard silicon carbonitride films obtained by RF-plasma-enhanced chemical vapour deposition using the single-source precursor bis(trimethylsilyl)carbodiimide. In: J. Eur. Ceram. Soc. Band 26, 2006, S. 1325–1335, doi:10.1016/j.jeurceramsoc.2005.02.004.

