Berylliumiodid
Berylliumiodid ist das Berylliumsalz der Iodwasserstoffsäure mit der Verhältnisformel BeI2. Die hygroskopische, stark toxische Substanz bildet tetragonale[6] oder rhombische weiße Nadeln und reagiert heftig mit Wasser.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
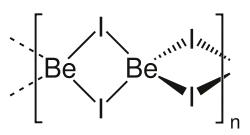 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Berylliumiodid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | BeI2 | |||||||||||||||
| Kurzbeschreibung |
weiße Nadeln[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 262,82 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
4,325 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
590 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−192,5 kJ/mol[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
Berylliumiodid kann aus den Elementen bei 500–700 °C hergestellt werden.[1][7]
Ebenso ist die Reaktion von Berylliumcarbid und Iodwasserstoff in der Gasphase (Stickstoff) bei 600–700 °C möglich.[7]
Eigenschaften
Berylliumiodid ist ein sehr hygroskopisches, weißes Pulver, das mit Wasser heftig unter Bildung von Iodwasserstoff reagiert.[1]
Das Iod im Berylliumiodid wird leicht von anderen Halogenen verdrängt: mit Fluor entstehen Berylliumfluorid und verschiedene Iodfluoride, mit Chlor und Brom bilden sich Berylliumchlorid und Berylliumbromid. Mit Oxidationsmitteln wie Kaliumpermanganat oder Kaliumchlorat wird das Iodid in einer heftigen Reaktion zum elementaren Iod oxidiert.[2] In der Dampfphase existiert Berylliumiodid als Dimer. Bei 1200 °C zersetzt sich der Dampf in die Elemente.[7] Die Bildungsenthalpie von Berylliumiodid beträgt 21,80 kJ/mol, die Verdampfungsenthalpie 70,5 kJ/mol.[1] Vom Berylliumiodid sind drei unterschiedliche Kristallstrukturen bekannt.[7]
Gitterparameter der verschiedenen Modifikationen von Berylliumiodid[7]
| Temperaturbereich | Kristallsystem | a [Å] | b [Å] | c [Å] |
|---|---|---|---|---|
| bis 290 °C | orthorhombisch | 11,18 | 5,94 | 6,04 |
| 290 °C bis 370 °C | orthorhombisch | 18,0 | 16,69 | 11,43 |
| über 370 °C | tetragonal | 5,84 | - | 5,70 |
Einzelnachweise
- Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 63 (eingeschränkte Vorschau in der Google-Buchsuche).
- C. L. Parsons: "The Chemistry and Literature of Beryllium", Chemical Publishing (1909). Volltext
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag beryllium compounds with the exception of aluminium beryllium silicates, and with those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Berylliumverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-6.
- Jean D'Ans, Ellen Lax, Roger Blachnik(Hrsg.): Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 3-540-60035-3, S. 334.
- Kenneth A. Walsh: "Beryllium chemistry and processing", ASM International (2009). p. 118 (eingeschränkte Vorschau in der Google-Buchsuche)


