Berylliumcarbid
Berylliumcarbid ist eine chemische Verbindung, die aus Beryllium und Kohlenstoff besteht.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
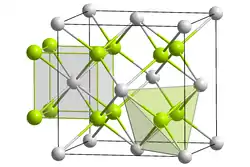 | |||||||||||||||||||
| _ Be2+ _ C4− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Berylliumcarbid | ||||||||||||||||||
| Verhältnisformel | Be2C | ||||||||||||||||||
| Kurzbeschreibung |
gelbrote Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 30,03 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,90 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
reagiert langsam mit Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Herstellung
Berylliumcarbid kann aus den Elementen hergestellt werden.[1] Bei 900 °C setzt eine exotherme Reaktion ein, die das Reaktionsgemisch auf 1400 °C erhitzt.[4]
Ebenso ist die Reaktion von Berylliumoxid und Kohlenstoff bei hoher Temperatur möglich.[5]
Bei höheren Temperaturen entsteht Kohlenmonoxid.[6]
Eigenschaften
Berylliumcarbid bildet gelbrote kubische[7] Kristalle, die langsam mit Wasser unter Bildung von Berylliumhydroxid und Methan reagieren.[5]
Da das entstehende Berylliumhydroxid amphoter ist, wird die Reaktion in Anwesenheit von Alkalihydroxiden unter Bildung von wasserlöslichen Beryllaten beschleunigt.[8]
Daraus ergibt sich für die gesamte wasserkatalysierte Reaktion:
Fluor, Chlor und Brom reagieren mit Berylliumcarbid in der Hitze zu den entsprechenden Berylliumhalogeniden unter Bildung von Kohlenstoff.[5]
Einzelnachweise
- Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 62 (eingeschränkte Vorschau in der Google-Buchsuche).
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag beryllium compounds with the exception of aluminium beryllium silicates, and with those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Berylliumverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Kenneth A. Walsh: "Beryllium chemistry and Processing", ASM International (2009). p. 117 (eingeschränkte Vorschau in der Google-Buchsuche)
- C. L. Parsons: "The Chemistry and Literature of Beryllium", Chemical Publishing (1909), p. 26. Volltext
- K. Motzfeld: "Equilibrium of the Reaction between Beryllium Oxide and Carbon to Give Beryllium Carbide" in Acta Chemica Scandinavica 1964, 18, p. 495–503. doi:10.3891/acta.chem.scand.18-0495
- Eintrag bei chemicals.etacude.com
- Vorlesungsskriptum: "Chemie der Metalle", Universität Freiburg


