Berylliumchlorid
Berylliumchlorid ist das Berylliumsalz der Salzsäure mit der Summenformel BeCl2. Das Salz dient unter anderem zur Herstellung von metallischem Beryllium durch Schmelzflusselektrolyse.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
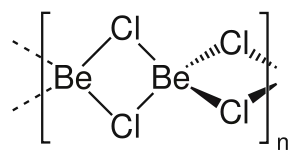 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Berylliumchlorid | ||||||||||||||||||
| Andere Namen |
Chlorberyllium | ||||||||||||||||||
| Summenformel | BeCl2 | ||||||||||||||||||
| Kurzbeschreibung |
süß schmeckende, farblose, zerfließende Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 79,92 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,9 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
482 °C[1] | ||||||||||||||||||
| Sublimationspunkt | |||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser, Ethanol und anderen organischen Lösungsmitteln[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−490,4 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
BeCl2 wird technisch aus Berylliumoxid, Kohlenstoff und Chlor bei ca. 800 °C hergestellt[7]:
Geringe Mengen der reinen Verbindung können im Labor über die direkte Synthese aus den Elementen bei 350 °C und anschließender Sublimation des Chlorides dargestellt werden[2]:
Physikalische Eigenschaften
Die Be-Cl-Bindung hat stark kovalente Bindungsanteile. Berylliumchlorid bildet daher auch kein Ionengitter wie etwa Magnesium- oder Calciumchlorid, sondern eine kettenförmige polymere Struktur, in der jeder Berylliumkern tetraedrisch von vier Chloratomen umgeben ist. Die Struktur entspricht in ihrem Aufbau der faserigen Form von Siliciumdioxid.
In der Gasphase finden sich monomere und dimere BeCl2-Einheiten, in denen der intrinsische Elektronenmangel am Berylliumatom durch partiellen Doppelbindungscharakter der Be-Cl-Bindung verringert wird. Die Bindungslänge im Monomer beträgt 170 pm.[8]
Chemische Eigenschaften
Berylliumchlorid ist stark hygroskopisch. Es geht in einer stark exothermen Hydrolyse in Lösung, wobei die wässrige Lösung sauer reagiert.
Die Tetraaquaberyllium-Kationen reagieren dabei als Aquasäure und dissoziieren.
Als Lewis-Säure löst sich BeCl2 in Donorlösungsmitteln, wie z. B. Alkoholen oder Ethern, wobei Addukte gebildet werden. BeCl2 kann dementsprechend als Katalysator in einer Friedel-Crafts-Alkylierung eingesetzt werden.
Berylliumchlorid wird beim Schmelzen mit Natrium unter Luftabschluss zu elementarem Beryllium reduziert.[9]
Verwendung
Durch Reaktion von wasserfreiem Berylliumchlorid mit wasserfreier Ameisensäure entsteht unter Entwicklung von Chlorwasserstoff Berylliumformiat.[10][11]
Einzelnachweise
- Eintrag zu Beryllium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- Irving R. Tannenbaum: Beryllium chloride. In: Therald Moeller (Hrsg.): Inorganic Syntheses. Band 5. McGraw-Hill, Inc., 1957, S. 22–25 (englisch).
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Berylliumverbindungen, ausgenommen Beryllium-Tonerdesilikate, und ausgenommen die namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 9. Januar 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Berylliumchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Hygiene and Sanitation. Vol. 30(1–3), S. 169, 1965.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-6.
- Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1108.
- L. F. Nilson, O. Petterssen: Ueber die specifische Wärme des Berylliums. In: Berichte der Deutschen Chemischen Gesellschaft 1878, 11, S. 381–386. (Digitalisat auf Gallica)
- H. Funk, F. Römer: "Über die Reaktion einiger wasserfreier Chloride mit wasserfreier Essigsäure und Ameisensäure" in Zeitschrift für anorganische und allgemeine Chemie 1938, 239(3), S. 288–294. doi:10.1002/zaac.19382390308
- G. B. Feild: "Reactions of Beryllium Chloride. Normal and Basic Organic Salts of Beryllium" in J. Am. Chem. Soc. 1939, 61(7), S. 1817–1820 doi:10.1021/ja01876a050


