Paal-Knorr-Synthese
Die Paal-Knorr-Synthese ist eine Namensreaktion der organischen Chemie, die 1884 von Ludwig Knorr und Carl Paal erstmals beschrieben wurde.[1] Das Verfahren dient der Synthese von fünfgliedrigen Heterocyclen, also substituierten Furanen, Thiophenen und Pyrrolen, ausgehend von 1,4-Diketonen (γ-Diketonen).[2][3]
Übersichtsreaktionen
Bei der Paal-Knorr-Synthese werden 1,4-Diketone entweder mit Säurekatalysatoren, Aminen oder Phosphor(V)-sulfid zu heteroaromatischen Hetereocyclopentadienen umgesetzt.
- Die Furan-Synthese benötigt Säurekatalysatoren,[4] es entstehen 2,5-disubstituierte Furane:
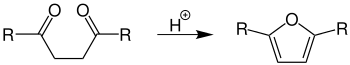 Übersichtsreaktion der Paal-Knorr-Furan-Synthese
Übersichtsreaktion der Paal-Knorr-Furan-Synthese
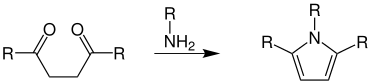 Übersichtsreaktion der Paal-Knorr-Pyrrol-Synthese
Übersichtsreaktion der Paal-Knorr-Pyrrol-Synthese
- Für die Herstellung 2,5-disubstituierter Thiophene wird Phosphor(V)-sulfid benötigt:
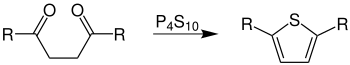 Übersichtsreaktion der Thiophen-Synthese aus 1,4-Diketonen
Übersichtsreaktion der Thiophen-Synthese aus 1,4-Diketonen
Bei den Verbindungen sind die Reste R diverse Organylreste, z. B. Alkylreste.
Mechanismus
Furan-Synthese
Im ersten Schritt wird eine Carbonylgruppe des Diketons 1 protoniert, wodurch das Kation 2 gebildet wird. Im darauffolgenden Schritt wird das Sauerstoffatom der anderen Carbonylgruppe nukleophil unter Ringschluss an die protonierte Carbonylgruppe addiert. Gleichzeitig spaltet sich ein Proton ab, wodurch das Hydroxyfuran 3 entsteht:

Die Hydroxygruppe des Hydroxyfurans 3 wird protoniert, sodass die reaktive Zwischenstufe 4 gebildet wird. Diese reagiert durch Dehydratisierung und Deprotonierung weiter zum Furan 5:[5]

Pyrrol-Synthese
Nach Amaraths Veröffentlichung findet der Mechanismus wahrscheinlich als direkte Einführung eines Halbaminals statt. Gestützt wird diese Annahme von seinen Forschungsergebnissen, nach denen die stereochemische Konfiguration der Ausgangsverbindung erhalten bleibt.[6]
Es ist anzunehmen, dass zunächst eine nukleophile Addition des Amins als Nukleophil an das Kohlenstoffatom einer Carbonylgruppe des Diketons 1 erfolgt. Es entsteht eine reaktive Zwischenstufe 2, die durch Protonentransfer zum Ketoaminol 3 reagiert. Dieses Ketoaminol kann auch als Halbaminal bezeichnet werden, wenn man den Stickstoff mit der Hydroxygruppe vordergründig betrachtet.
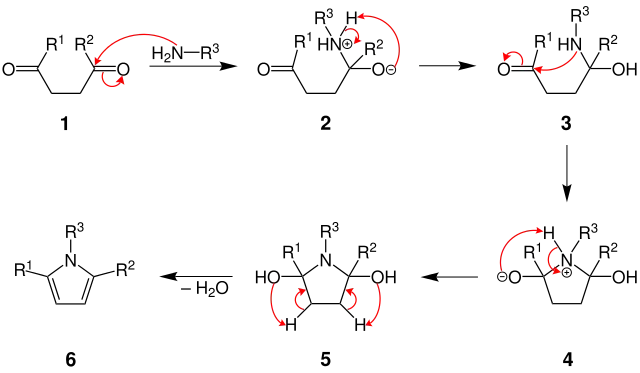
Im nächsten Schritt findet eine weitere nukleophile Addition statt. Der Stickstoff des Aminols 3 wird unter Ringschluss nukleophil an die zweite Carbonylgruppe addiert und reagiert zu einer polaren Zwischenstufe 4. Durch Protonierung des Sauerstoffatoms mit gleichzeitiger Deprotonierung des Stickstoffs, bildet sich das Diaminol 5. Unter Dehydratisierung entsteht das Pyrrolderivat 6.[7]
Thiophen-Synthese
Ein möglicher Mechanismus der Synthese eines Thiophens wurde von Foye vorgeschlagen.[8]

Zunächst wird das 1,4-Diketon 1 mit Phosphor(V)-sulfid versetzt. Phosphorpentasulfid ist ein Thionierungs- und Dehydratisierungs-Reagenz, was die Bildung von Furan begünstigen könnte. Jedoch hat Foye experimentell herausgefunden, dass Furan kein Zwischenprodukt der Thiophen-Synthese ist.[8] Durch die Einführung von Schwefel in die Dicarbonylverbindung 1 reagiert diese zum Thioketon 2. Das Sauerstoffatom wird protoniert, sodass das Kation 3 gebildet wird.

Der Schwefel greift das Kohlenstoffatom der Hydroxygruppe nukleophil an, worauf unter Deprotonierung der Verbindung 3 das heterocyclische Thiohalbacetal 4 entsteht. Dessen Abspaltung von Wasser erfolgt unter Bildung des 2,5-disubstituierten Thiophens 5.
Einzelnachweise
- Zero Wang: Comprehensive Organic Name Reactions an Reagents. 3 Bände. John Wiley & Sons, 2009, ISBN 978-0-471-70450-8, S. 2107.
- Carl Paal: Synthese von Thiophen- und Pyrrolderivaten. In: Berichte der deutschen chemischen Gesellschaft. 18, Nr. 1, 1885, S. 367–371. doi:10.1002/cber.18850180175.
- Ludwig Knorr.: Einwirkung des Diacetbernsteinsäureesters auf Ammoniak und primäre Aminbasen. In: Berichte der deutschen chemischen Gesellschaft. 18, Nr. 1, 1885, S. 299–311. doi:10.1002/cber.18850180154.
- T.L. Gilchrist: Heterocyclic chemistry. ISBN 0-582-01421-2.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Science & Technology Books, 2005, ISBN 0-12-369483-3, S. 498.
- Venkataraman Amarnath, Douglas C. Anthony, Kalyani Amarnath, William M. Valentine, Lawrence A. Wetterau, Doyle G. Graham: Intermediates in the Paal-Knorr synthesis of pyrroles. In: The Journal of Organic Chemistry. Band 56, Nr. 24, 1991, S. 6924–6931, doi:10.1021/jo00024a040.
- Adalbert Wollrab: Organische Chemie. Springer-Verlag, 1999, ISBN 3-540-43998-6, S. 850.
- E. Campaigne, William O. Foye: The Synthesis of 2,5-Diarylthiophenes. In: The Journal of Organic Chemistry. Band 17, Nr. 10, 1952, S. 1405–1412, doi:10.1021/jo50010a023.