Knorr-Pyrrolsynthese
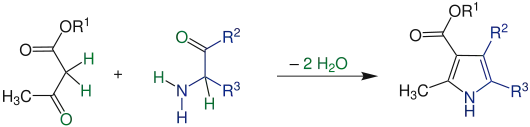
Die Knorr-Pyrrolsynthese ist eine verbreitete chemische Reaktion zur Synthese von substituierten Pyrrolen.[1][2][3] Sie ist nach ihrem Entdecker, dem deutschen Chemiker Ludwig Knorr, benannt und gehört zu den Namensreaktionen. Bei dieser Reaktion werden α-Amino-ketone und β-Ketoester zu Pyrrolen umgesetzt.[4] Die Reaktion wird in Anwesenheit von Zink durchgeführt und findet aufgrund der hohen Reaktivität der α-Amino-ketone bei Raumtemperatur statt. Da α-Aminoketone nicht stabil sind und mit sich selbst eine Kondensationsreaktion eingehen, müssen sie in situ, zum Beispiel aus den Oximen, freigesetzt werden.[5][6] Die erhaltenen Heterocyclen werden auch als Knorr-Pyrrole bezeichnet.
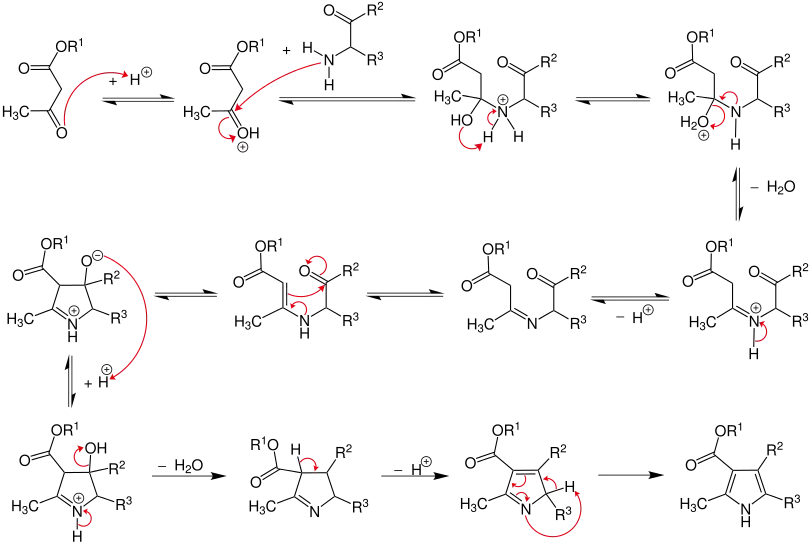
Reaktionsmechanismus
Im ersten Schritt wird der β-Ketoester protoniert und im Anschluss vom α-Aminoketon angegriffen. Nach intramolekularer Protonenübertragung vom Ammonium zur Hydroxygruppe und Eliminierung von Wasser bildet sich das Imin nach abschließender Deprotonierung. Dieses tautomerisiert zu einem Enamin. Durch Angriff der Doppelbindung am elektronenarmen Carbonylkohlenstoff bildet sich nun ein N-Heterocyclus. Im nächsten Schritt wird das negative geladene Sauerstoffatom durch Bildung eines Imins zur Hydroxygruppe protoniert, welche schließlich nach finaler Wassereliminierung und Ausbildung einer weiteren Doppelbindung unter erneuter Imin/Enamin Tautomerie das Pyrrol bildet.
In der ursprünglichen Knorr-Pyrrolsynthese wurden zwei Äquivalente Acetessigsäureethylester umgesetzt. Dabei wurde ein Äquivalent durch Eisessig und Natriumnitrit zum 2-Oximinoacetessigsäureester umgesetzt. Zinkstaub reduziert nun das Oxim zum aktiven Amin und die Kondensationsreaktion kann einsetzen.
Es existieren zahlreiche modernere Varianten zu dem klassischen Verfahren von Knorr. Von Levi und Zanetti existiert eine Erweiterung der Knorr-Pyrrolsynthese auf Acetylaceton (2,4-Pentandion), das mit dem Oxim zu Pyrrolen umgesetzt wird.[7]
Einzelnachweise
- Knorr, L. Berichte der deutschen chemischen Gesellschaft, 1884, 17, 1635.
- Knorr, L. Liebigs Ann. Chem., 1886, 236, 290.
- Knorr, L.; Lange, H. Berichte der deutschen chemischen Gesellschaft, 1902, 35, 2998.
- Corwin, A. H. Heterocyclic Compounds, 1950, 1, 287.
- Fischer, H.: 2,4-Dimethyl-3,5-Dicarbethoxypyrrole In: Organic Syntheses. 15, 1935, S. 17, doi:10.15227/orgsyn.015.0017; Coll. Vol. 2, 1943, S. 202 (PDF).
- Fischer, H.: Kryptopyrrole In: Organic Syntheses. 21, 1941, S. 67, doi:10.15227/orgsyn.021.0067; Coll. Vol. 3, 1955, S. 513 (PDF).
- Zanetti, C.U.; Levi, E. Gazz. Chim. Ital. 1894, 24, I, 546.