Lanosterin-Demethylase
Das Enzym Lanosterin-Demethylase (auch: CYP51A1) katalysiert die dehydrierende Demethylierung von Lanosterin zum 4,4-Dimethyl-5α-cholesta-8,14,24-trien-3β-ol. Diese chemische Reaktion ist ein Zwischenschritt in der Cholesterin- und der Ergosterinbiosynthese, die in Eukaryoten, aber auch in manchen Bakterien stattfindet. Es handelt sich um eine Monooxygenase vom Cytochrom P450-Typ, also mit Häm als Cofaktor. CYP51A1 wird vom Menschen in vielen Gewebetypen produziert.[1]
| Lanosterin-Demethylase | ||
|---|---|---|
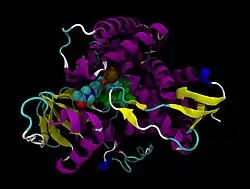 | ||
| Bändermodell der menschlichen CYP51A1 mit Häm (grün) und Ketoconazol ala Kalotten, nach PDB 3LD6 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 503 Aminosäuren | |
| Kofaktor | Häm | |
| Isoformen | 1, 2 | |
| Bezeichner | ||
| Gen-Name | CYP51A1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.14.13.70, Monooxygenase | |
| Reaktionsart | mehrmalige Oxidation mit Abspaltung | |
| Substrat | 14-Methyl-Steroid + 3 O2 + 3 NADPH | |
| Produkte | 14-Demethyl-Steroid + Formiat + 4 H2O + 3 NADP+ | |
| Vorkommen | ||
| Übergeordnetes Taxon | Eukaryoten, manche Bakterien | |
Katalysierte Reaktion
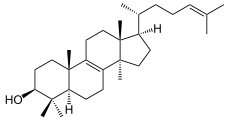
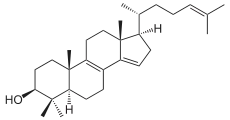
In mehreren Oxidationsschritten wird die 14-Methylgruppe des Lanosterins entfernt und eine 14,15-Doppelbindung erzeugt, wobei Formiat abgespalten wird. Auch andere 14-Methyl-Steroide (Eburicol, Norlanosterin, Obtusifoliol) werden als Substrat akzeptiert.[2]