Polypyrrol
Polypyrrol (Abkürzung PPy) ist eine polymere chemische Verbindung, die aus 2,5-verketteten Pyrrol-Einheiten besteht. Es gehört zur Klasse der leitfähigen Polymere. Das über das gesamte Molekül ausgedehnte System von konjugierten Doppelbindungen in Verbindung mit einer „Dotierung“ mit einem negativ geladenen Gegenion ermöglicht die Leitfähigkeit. Im oxidierten, leitfähigen Zustand werden die Ladungen der Defektelektronen in den konjugierten Ketten durch eingelagerte Anionen kompensiert.
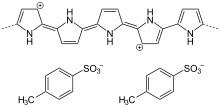

Synthese
Polypyrrol wird durch oxidative Polymerisation von Pyrrol hergestellt. Bei der chemischen Präparation fällt es als unlöslicher, schwarzer Niederschlag aus. Ein geeignetes Oxidationsmittel ist Eisen(III)-chlorid (FeCl3). Wasser, Methanol, Ethanol, Acetonitril und andere polare Lösungsmittel können für die Synthese verwendet werden.[1] Bei der elektrochemischen Polymerisation von Pyrrol scheidet sich Polypyrrol als schwarze, elektrisch leitfähige Schicht auf der Anode ab. Um n Pyrroleinheiten zu verketten, werden idealerweise 2n-2 Elektronen entzogen. Das Polypyrrol wird während der Polymerisation wegen seines im Vergleich zum Pyrrol niedrigeren Oxidationspotentials ebenfalls oxidiert. Der Oxidationsgrad liegt in der Regel zwischen 0,25 und 0,4. Folglich trägt jede dritte bis vierte Monomereinheit in der Polymerkette eine positive Ladung.[2] Zur Ladungskompensation werden deshalb während der Polymerbildung Anionen des Leitsalzes eingebaut.
Reaktionsmechanismus
Pyrrol wird im ersten Reaktionsschritt zum Radikalkation oxidiert, das ein wesentliches Intermediat der oxidativen Polymerisation ist. Zwei Radikalkationen koppeln zum dimeren Dikation. Möglicherweise werden bereits während dieser Dimerisierung simultan zwei Wasserstoffionen abgespalten.[3] Da das Oxidationspotential des nun gebildeten Bipyrrols unter dem des Pyrrols liegt, wird es sofort zum Radikalkation oxidiert. Die Polymerisation setzt sich allerdings nur dann fort, wenn das Oxidationspotential ausreichend hoch bleibt, um weiteres Pyrrol zum Radikalkation zu oxidieren.
Nebenreaktionen
Die Polymerisation des Pyrrols wird in einer wässrigen Elektrolytlösung mit pH-Puffer bei pH 7 unterdrückt.[4] Folglich ist die Gegenwart von Wasserstoffionen bei der Polymerisationsreaktion entscheidend. Bei einem zu hohen pH-Wert deprotoniert das Stickstoffatom des Radikalkations. Das Radikal reagiert zu einem nicht leitfähigem Polymer. Die elektrochemische Polymerisation bei einem zu hohen pH-Wert ergibt dünne, isolierende Schichten. Bei sehr niedrigen pH-Werten reagiert Pyrrol zum 2,5-Bis(2-pyrrolyl)pyrrolidin (Pyrroltrimer). Durch diese Konkurrenzreaktion werden gesättigte Pyrrolidinringe eingebaut, die die Konjugation der Polymerketten unterbrechen und sich damit negativ auf die elektrische Leitfähigkeit des Polypyrrols auswirken.[5]
Anwendung
Polypyrrol wird in der Sensortechnik, Solarzellentechnik und Mikrobiologie verwendet. Durch spezielle Verfahren kann man selbst Enzyme auf der Polypyrroloberfläche immobilisieren.
Einzelnachweise
- S. Machida, S. Miyata, A. Techagumpuch: Chemical synthesis of highly electrically conductive polypyrrole. In: Synthetic Metals. Band 31, Nr. 3, September 1989, S. 311–318, doi:10.1016/0379-6779(89)90798-4.
- Jürgen Heinze: Electronically conducting polymers. In: Eberhard Steckhan (Hrsg.): Electrochemistry IV (= Topics in Current Chemistry). Band 152. Springer, Berlin/Heidelberg 1990, ISBN 978-3-540-51461-9, S. 1–47.
- Stephen V. Lowen, John D. Van Dyke: Mechanistic studies of the electrochemical polymerization of pyrrole: Deuterium isotope effects and radical trapping studies. In: Journal of Polymer Science Part A: Polymer Chemistry. Band 28, Nr. 3, Februar 1990, S. 451–464, doi:10.1002/pola.1990.080280301.
- Renyuan Qian, Yongfang Li, Baozhen Yan, Huiming Zhang: Electrochemical aspects of polypyrrole. In: Synthetic Metals. Band 28, Nr. 1–2, 30. Januar 1989, S. 51–58, doi:10.1016/0379-6779(89)90498-0.
- T. F. Otero, J. Rodríguez: Role of protons on the electrochemical polymerization of pyrrole from acetonitrile solutions. In: Journal of Electroanalytical Chemistry. Band 379, Nr. 1–2, 12. Dezember 1994, S. 513–516, doi:10.1016/0022-0728(94)87178-7.