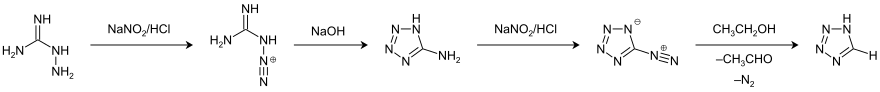
Tetrazol
Tetrazol ist eine heterocyclische chemische Verbindung, für die drei isomere Strukturen formuliert werden können.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Strukturformel des Tautomers 1H-Tetrazol | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetrazol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH2N4 | |||||||||||||||
| Kurzbeschreibung |
farblose, sublimierbare Blättchen (1H-Tetrazol) [1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 70,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,406 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert |
4,89[4] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Tautomerie
Je nach Lage der Doppelbindungen unterscheidet man die isomeren Strukturen 1H-, 2H- und 5H-Tetrazol. 1H- und 2H-Tetrazol bilden ein Tautomeriegleichgewicht, das im kristallinen Feststoff auf der Seite des 1H-Tetrazols liegt.[6][7][8] In der Gasphase dominiert das 2H-Tautomer.[7][9][10] Sowohl das 1H-Tetrazol (links) als auch das 2H-Tetrazol (Mitte) können als 6π-Heteroaromaten aufgefasst werden:
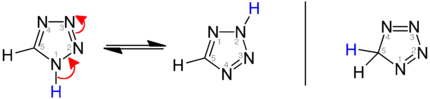
Darstellung
1H-Tetrazol entsteht durch Reaktion von Blausäure mit Stickstoffwasserstoffsäure.[1] Bei dieser Reaktion handelt es sich um eine 1,3-dipolare Cycloaddition. Die Verbindung kann auch durch die Deaminierung von kommerziell erhältlichem 5-Aminotetrazol, welches leicht aus Aminoguanidin hergestellt werden kann, gewonnen werden.[11][12]
Eigenschaften
1H-Tetrazol ist ein kristalliner Feststoff, der in zwei polymorphen Formen auftritt. Die beiden Kristallformen stehen enantiotrop zueinander. Unterhalb der Umwandlungstemperatur von −31 °C liegt die Form II vor. Oberhalb der Umwandlungstemperatur ist die Form I die thermodynamisch stabile Kristallform. Diese zeigt einen Schmelzpunkt bei 157 °C.[3] Die Schmelzenthalpie beträgt 18,4 kJ·mol−1[13], die Umwandlungsenthalpie am Fest-fest-Phasenübergang 14,0 J·mol−1.[3] Die Dampfdruckfunktion ergibt sich nach August entsprechend ln(P) = −A/T+B (P in Pa, T in K) mit A = 10560 ±168 und B = 31,148 ±0,458 im Temperaturbereich von 333 K bis 404 K.[3] Aus der Dampfdruckfunktion lässt sich eine molare Sublimationsenthalpie von 87,8 kJ·mol−1 ableiten.[3] Die Verbindung ist mit einer Standardbildungsenthalpie von ΔfHsolid = 236 kJ·mol−1 bzw. ΔfHgas = 320 kJ·mol−1 stark endotherm.[14][15] Die Standardverbrennungsenthalpie ΔcHsolid beträgt −915,5 kJ·mol−1.[14][15] Die wässrige Lösung von 1H-Tetrazol reagiert schwach sauer und hat etwa die gleiche Acidität wie Essigsäure.[1][4] Es konnten eine Reihe von Salzen wie das Lithium–, Natrium–, Kalium–, Rubidium–, Cäsium–, Strontium–, Ammonium- und Hydraziniumsalz hergestellt und charakterisiert werden.[16] Mit eine Schlagenergie <4 J ist die Verbindung extrem schlagempfindlich. Gegenüber Reibung wurde bis 360 N keine Empfindlichkeit festgestellt.[16]
Bedeutung
Von den Derivaten des 1H-Tetrazols haben Tetrazoliumsalze besondere Bedeutung in der Biochemie. Die Bedeutung der Tetrazole in der Pharmazie liegt in der Bioisosterie zur Carboxygruppe. In 5-Position substituierte 1H-Tetrazole haben ähnliche physikalische Eigenschaften wie ihre Carboxy-Analoga, zeigen aber eine höhere Stabilität gegenüber der Metabolisierung. Bekannte Pharmazeutika sind zum Beispiel das Losartan oder auch das Pentamethylentetrazol oder auch Pentetrazol, ein Analeptikum.
Sicherheit
1H-Tetrazol ist von der Bundesanstalt für Materialforschung und -prüfung (BAM) im Sinne des Sprengstoffgesetzes als explosionsgefährlicher Stoff in der Stoffgruppe A eingestuft.[17]
Weblinks
Einzelnachweise
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1391.
- W. C. McCrone, D. Grabar, E. Lieber: Crystallographic Data. 42. Tetrazole in Anal. Chem. 23 (1951) 543, doi:10.1021/ac60051a052.
- G. J. Kabo, A. A. Kozyro, A. P. Krasulin, V. M. Sevruk, L. S. Ivashkevich: Thermodynamic properties and tautomerism of tetrazole in J. Chem. Thermodyn. 25 (1993) 485–493, doi:10.1006/jcht.1993.1156.
- E. Lieber, S.H. Patinkin, H.H. Tao: The Comparative Acidic Properties of Some 5-Substituted Tetrazoles in J. Am. Chem. Soc. 73 (1951) 1792–1795, doi:10.1021/ja01148a111.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Goddard, R.; Heinemann, O.; Krüger, C.: α–1H–1,2,3,4–Tetrazole in Acta Cryst. C 53 (1997) 590–592, doi:10.1107/S0108270197000772.
- Kiselev, V.G.; Cheblakov, P.B.; Gritsan, N.P.: Tautomerism and Thermal Decomposition of Tetrazole: High-Level ab Initio Study in J. Phys. Chem. A 115 (2011) 1743–1753, doi:10.1021/jp112374t.
- van der Putten, N.; Heijdenrijk, D.; Schenk, H.: in Cryst. Struct. Comm. 1974, 321.
- Wong, M.W.; Leung-Toung, R.; Wentrup, C.: Tautomeric Equilibrium and Hydrogen Shifts of Tetrazole in the Gas Phase and in Solution in J. Am. Chem. Soc. 115 (1993) 2465–2472.
- Razynska, A.; Tempczyk, A.; Malinski, E.; Szafranek, J.; Grzonka, Z.; Hermann, P.: in J. Chem. Soc. Perkin Trans. 2 1983, 379.
- R.A. Henry, W.G. Finnegan: An Improved Procedure for the Deamination of 5-Aminotetrazole in J. Am. Chem. Soc. 76 (1954) 290–291, doi:10.1021/ja01630a086.
- F. Kurzer, L.E.A. Godfrey: Synthesen heterocyclischer Verbindungen aus Aminoguanidin in Angew. Chem. 75 (1963) 1157–1175, doi:10.1002/ange.19630752303.
- F.R. Hilgeman, F.Y.N. Mouroux, D. Mok, M.K. Holan: Phase Diagrams of Binary Solid Azole Systems in J. Chem. Eng. Data 34 (1989) 220–222, doi:10.1021/je00056a022.
- A.A. Balepin, V.P. Lebedev, E.A. Miroshnichenko, G.I. Koldobskii, V.A. Ostovskii, B.P. Larionov, B.V. Gidaspov, Yu.A. Lebedev: Energy effects in polyphenylenes and phenyltetrazoles in Svoistva Veshchestv Str. Mol., 1977, 93–98.
- W.S. McEwan, W.S., M.W. Rigg: The heats of combustion of compounds containing the tetrazole ring in J. Am. Chem. Soc. 73 (1951) 4725–4727, doi:10.1021/ja01154a072.
- Klapötke, T.M.; Stein, M.; Stierstorfer, J.: Salts of 1H-Tetrazole – Synthesis, Characterization and Properties in Z. Anorg. Allg. Chem. 634 (2008) 1711–1723, doi:10.1002/zaac.200800139.
- Bekanntmachung der gemäß § 2 SprengG von der BAM seit 1987 neu getroffenen Feststellungen – Feststellungsbescheid Nr. 301 vom 31. März 1994 pdf-Link.