δ-Valerolacton
δ-Valerolacton (delta-Valerolacton, Oxan-2-on) ist das pyranoide Lacton der 5-Hydroxyvaleriansäure (5-Hydroxypentansäure), während die stellungsisomeren Tetrahydropyranone Oxan-3-on und Oxan-4-on cyclische Etherketone darstellen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | δ-Valerolacton | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C5H8O2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 100,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
δ-Valerolacton findet vor allem Verwendung als Monomer für Polyester, das stellungsisomere furanoide γ-Valerolacton (4-Hydroxypentansäurelacton) als biogener Brennstoff und als „grünes“ Lösungsmittel.
Herstellung
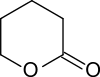
Bei der Hydrierung von 5,6-Dihydro-2H-pyran-2-on – zugänglich in 25%iger Ausbeute durch Umsetzung von 3-Butensäure mit Paraldehyd in einem Gemisch von konzentrierter Schwefelsäure und Eisessig[7] mit einem Ferrocen-basierten Palladium(II)-Komplex[8] wird delta-Valerolacton in 99%iger Ausbeute erhalten.
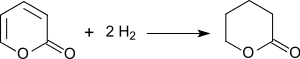
δ-Valerolacton entsteht in 96%iger Ausbeute bei der Cyclisierung von 5-Bromvaleriansäure – z. B. aus Dihydropyran durch Acidolyse zu δ-Hydroxyvaleraldehyd,[9] anschließende Oxidation zur δ-Hydroxyvaleriansäure und Umsetzung mit Bromwasserstoffsäure[10] – mit Tetraalkylammoniumfluoriden[11]
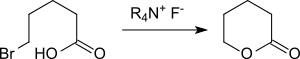
Ein gängigerer Syntheseweg ist die Baeyer-Villiger-Oxidation von Cyclopentanon mit Peroxytrifluoressigsäure, die δ-Valerolacton in 96%iger Ausbeute liefert.[12]
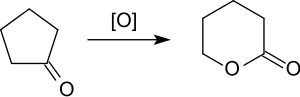
Die Oxidation kann auch in Gegenwart von Molybdän-Komplexen mit Wasserstoffperoxid durchgeführt werden.[13] Eine „grüne“ Route mit sehr guter Ausbeute von 98 % zeigt die Oxidation von Cyclopentanon mit Wasserstoffperoxid und einer Lipase auf.[14]
Für die großtechnische Produktion von δ-Valerolacton scheint das einfach zugängliche 1,5-Pentandiol das geeignetste Edukt zu sein, das z. B. auch durch destillative Auftrennung des komplexen, so genannten Ol/On-Stoffgemischs bei der Oxidation von Cyclohexan zu Cyclohexanol/Cyclohexanol isoliert werden kann.[15] Die Oxidation von 1,5-Pentandiol wird durch Kupferverbindungen, wie z. B. Kupferchromit katalysiert. Die Reaktionsführung bei Temperaturen über 200 °C ist entscheidend für Umsatz des Edukts und Reinheit des Produkts, wobei sich ein herkömmlicher Rührreaktor als wenig geeignet erweist, da beim Versuch der vollständigen Umsetzung von 1,5-Pentandiol 30–35 % polymere Nebenprodukte gebildet werden.[4][12]
In einem Rohrreaktor verläuft die Reaktion dagegen wesentlich gezielter zum Produkt, das unter Katalyse mit einem Kupfer(II)-oxid und Zinkoxid-Mischkatalysator reines δ-Valerolacton in 86%iger Ausbeute liefert.[16]
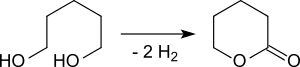
Ein industrieller Prozess führt die katalytische Dehydrogenierung in einem Rohrreaktor an zwei Katalysatorschichten mit unterschiedlichen Gehalten an Kupferoxid mit dem Trägergas Wasserstoff und einem Temperaturgradienten von 300 °C bis 260 °C bei praktisch vollständigem 1,5-Pentandiol-Umsatz, einer δ-Valerolactonselektivität von 96 % und einer δ-Valerolactonreinheit von >99 % durch.[17]
Eigenschaften
Reines δ-Valerolacton ist eine wasserklare, farblose Flüssigkeit mit esterartigem Geruch,[5] die in wässriger Lösung schwach sauer reagiert. Sie erstarrt bei −13 °C, siedet bei 230 °C und besitzt eine dynamische Viskosität von 3,41 mPa·s bei 20 °C.[5] Der Flammpunkt liegt bei 110,5 °C, die Zündtemperatur bei 414 °C. Bei Temperaturen über 370 °C beginnt sich δ-Valerolacton zu zersetzen.
Anwendungen
δ-Valerolacton wird als vielseitiges Zwischenprodukt für Beschichtungen vom Polyester-, Polyurethan-, Acryl- und Vinyltyp verwendet.[18]
Aus δ-Valerolacton lässt sich durch Reaktion mit Phosgen in Gegenwart von 3-Picolin in Ausbeuten bis 87 % und Reinheiten von >98 % 5-Chlorpentanoylchlorid herstellen[19].
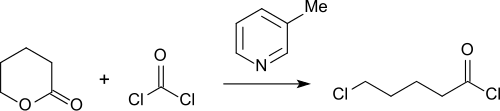
das als Ausgangssubstanz für eine Reihe von Zwischenstufen von Arzneistoffen, wie z. B. Virustatika[20], Phosphodiesterase-3-Hemmer, wie Cilostazol[21] oder Antikoagulanzien, wie Apixaban[22] breitere Verwendung findet.
Ähnlich wie das weitaus häufiger eingesetzte ε-Caprolacton kann δ-Valerolacton entsprechender Reinheit durch kationische ringöffnende Polymerisation z. B. mit Trifluormethansulfonsäuremethylester zu Poly-δ-Valerolacton[23] und mit anderen Lactonen bzw. δ-Hydroxycarbonsäuren auch durch anionische[24] sowie auch durch enzymatische Polymerisation[25] mittels Lipasen zu copolymeren Polyestern umgesetzt werden, die wegen ihrer Bioabbaubarkeit, Bioverträglichkeit und ihres Permeationsverhaltens als mögliche Implantatmaterialien interessant sind.
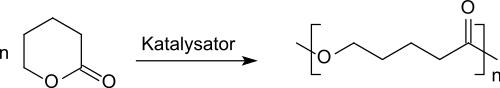
Wegen der Tendenz zur Depolymerisation vom Kettenende her (engl. back-biting)[23] und der geringeren Reaktivität des sechsgliedrigen Lactonrings im δ-Valerolacton gegenüber dem siebengliedrigen ε-Caprolacton werden bei der enzymatischen ringöffnenden Polymerisation Polymere mit vergleichsweise niedrigeren Molmassen erzeugt, die aber bei der Verwendung thermophiler Esterasen immerhin zahlenmittlere Molmassen von Mn >2,000 g/mol aufwiesen und das erhaltene Poly-δ-Valerolacton für die Verwendung als hydrophobe Weichsegmente in thermoplastischen Elastomeren oder als Wirkstoffträger für die kontrollierte Arzneistofffreigabe erscheinen lassen.[26]
Die kontrollierte lebende Polymerisation von δ-Valerolacton führt mit dem Katalysator Trifluormethansulfonimid zu Poly-δ-Valerolacton mit dem Katalysatoranteil entsprechenden Molmassen z. B. mit Mn = 9,600 g/mol und in Gegenwart funktioneller Initiatoren, wie z. B. N-(2-Hydroxyethyl)maleinimid zu endständig funktionalisierten telechelen Poly-δ-Valerolactonen mit kontrollierten Molmassen und geringer Polydispersität.[27]
Einzelnachweise
- Eintrag zu DELTA-VALEROLACTONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- Eintrag zu delta-Valerolacton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. Februar 2017. (JavaScript erforderlich)
- Datenblatt δ-Valerolacton bei Sigma-Aldrich, abgerufen am 10. Juni 2015 (PDF).
- L.E. Schniepp, H.H. Geller: Dehydrogenation of 1,5-pentanediol. In: J. Amer. Chem. Soc. Band 69, Nr. 6, 1947, S. 1545–1545, doi:10.1021/ja01198a517.
- BASF, Safety Data Sheet, [https://de.wikipedia.org/w/index.php?title=Wikipedia:Defekte_Weblinks&dwl=http://worldaccount.basf.com/wa/NAFTA/Catalog/ChemicalsNAFTA/doc4/BASF/PRD/30037103/.pdf?title=&asset_type=msds/pdf&language=EN&validArea=US&urn=urn:documentum:ProductBase_EU:09007af8800b6d1b.pdf Seite nicht mehr abrufbar], Suche in Webarchiven: [http://timetravel.mementoweb.org/list/2010/http://worldaccount.basf.com/wa/NAFTA/Catalog/ChemicalsNAFTA/doc4/BASF/PRD/30037103/.pdf?title=&asset_type=msds/pdf&language=EN&validArea=US&urn=urn:documentum:ProductBase_EU:09007af8800b6d1b.pdf delta-Valerolactone]
- Eintrag zu δ-Valerolacton bei TCI Europe, abgerufen am 5. Februar 2017.
- M. Nakahawa, J. Saegusa, M. Tonozuka, M. Obi, M. Kiuchi, T. Hino, Y. Ban: 5,6-Dihydro-2H-pyran-2-one and 2H-Pyran-2-one. In: Org. Synth., Coll. Vol. Band 6, 1977, S. 462–454, doi:10.15227/orgsyn.056.0049.
- H.M. Ali, A.A. Naiini, C.H. Brubaker Jr.: Selective reduction of conjugated double bonds with molecular hydrogen and palladium(II) complexed to ferrocenylamine sulfide catalysts. In: Tetrahedron Lett. Band 32, Nr. 40, 1991, S. 5489–5492, doi:10.1016/0040-4039(91)80065-E.
- L.E. Schniepp, H.H. Geller: Preparation of Dihydropyran, δ-Hydroxyvaleraldehyde and 1,5-Pentanediol from Tetrahydrofurfuryl Alcohol. In: J. Am. Chem. Soc. Band 68, Nr. 8, 1946, S. 1646–1648, doi:10.1021/ja01212a085.
- R. Gaudry, L. Berlinguet: Étude de la synthèse de la proline par cyclisation d’un acide valérianique dihalogéné. In: Can. J. Research. 27b, Nr. 4, 1949, S. 282–292, doi:10.1139/cjr49b-030.
- T. Oii, H. Sugimoto, K. Doda, K. Maruoka: Esterification of carboxylic acids catalyzed by in situ generated tetraalkylammonium fluorides. In: Tetrahedron Lett. Band 42, Nr. 52, 2001, S. 9245–9248, doi:10.1016/S0040-4039(01)02035-4.
- N. Isenberg, J.B. Leibsohn, V.E. Merola: 5-Bromopentanoic acid and 2,5-dibromopentanoic acid. In: Canadian Journal of Chemistry. 40, 1962, S. 831, doi:10.1139/v62-126.
- S.E. Jacobson, R. Tang, F. Mares: Oxidation of cyclic ketones by hydrogen peroxide catalysed by Group 6 metal peroxo complexes. In: J. Chem. Soc., Chem. Commun. 1978, S. 888–889, doi:10.1039/C39780000888.
- A.J. Kotlewska, F. van Rantwijk, R.A. Sheldon, I.W.C.E. Arends: Epoxidation and Baeyer–Villiger oxidation using hydrogen peroxide and a lipase dissolved in ionic liquids. In: Green Chem. Band 13, Nr. 8, 2011, S. 2154–2160, doi:10.1039/C1GC15255F.
- Patent DE10100552: Verfahren und Vorrichtung zur destillativen Aufarbeitung von 1,6-Hexandiol, 1,5-Pentandiol und Caprolacton. Angemeldet am 9. Januar 2001, veröffentlicht am 11. Juli 2002, Anmelder: BASF AG, Erfinder: M. Gall, G. Kaibel, T. Krug, H. Rust, F. Stein.
- S. Oka: Synthesis of δ-Valerolacton. In: Bull. Inst. Chem. Res., Kyoto University. Band 39, Nr. 4–5, 1961, S. 322–324 ().
- Patent EP2373637: Verfahren zur Herstellung von delta-Valerolacton in der Gasphase. Angemeldet am 2. Dezember 2009, veröffentlicht am 22. Mai 2013, Anmelder: BASF SE, Erfinder: R. Pinkos, C. Bauduin, A. Paul, G. Fritz, H. Wagner.
- BASF-Broschüre, Solvent-borne and high-solids coatings
- Patent WO2001064614: Verfahren zur Herstellung von Chlorcarbonsäurechloriden. Angemeldet am 28. Februar 2001, veröffentlicht am 7. September 2001, Anmelder: BASF AG, Erfinder: A. Stamm, H.-J. Kneuper, J. Henkelmann, T. Weber, R. Busch.
- Patent EP0509469: Synthetic compounds suitable for the therapy of infections caused by rhinoviruses. Angemeldet am 15. April 1992, veröffentlicht am 21. Oktober 1992, Anmelder: Repla Chemical Ltd., Erfinder: M. Artico, F. Corelli, S. Massa, A. Mai.
- Pharmaceutical Substances: Syntheses, Patents and Applications of the most relevant APIs. Herausgegeben von Axel Kleemann, Jürgen Engel, Bernhard Kutscher, Dietmar Reichert, Thieme Verlag, 5th Edition, Sept. 2008, ISBN 978-3-13-558405-8
- J. Wang, P. Wang, L. Liu, H. Zhang, Z. Shang, Synthesis of apixaban intermediate, J. Hebei Univ. Sci. Technol., 35, 334, (2014).
- H.R. Kricheldorf, R. Dunsing, A. Serra: Polylactones. 10. Cationic polymerization of δ-Valerolacton by means of alkylating agents. In: Macromolecules. Band 20, Nr. 9, 1987, S. 2050–2057, doi:10.1021/ma00175a002.
- P. Kurcok, J. Penczek, J. Franek, Z. Jedlinski: Anionic polymerization of lactones. 10. Anionic block copolymerization of δ-Valerolacton and L-Lactide initiated with potassium methoxide. In: Macromolecules. Band 25, Nr. 9, 1992, S. 2282–2289, doi:10.1021/ma00035a001.
- S. Kobayashi: Lipase-catalyzed polyester synthesis – A green polymer chemistry. In: Proc. Jpn. Acad. Ser. B Phys. Biol. Sci. Band 86, Nr. 4, 2010, S. 338–365, doi:10.2183/pjab.86.338, PMC 3417799 (freier Volltext).
- H. Cao, H. Han, G. Li, J. Yang, L. Zhang, Y. Yang, X. Fang, Q. Li: Biocatalytic Synthesis of Poly(δ-Valerolactone) Using a Thermophilic Esterase from Archaeoglobus fulgidus as Catalyst. In: Int. J. Mol. Sci. Band 13, Nr. 10, 2012, S. 12232–12241, doi:10.3390/ijms131012232.
- R. Kakuchi, Y. Tsuji, K. Chiba, K. Fuchise, R. Sakai, T. Satoh, T. Kakuchi: Controlled/Living Ring-Opening Polymerization of δ-Valerolactone Using Triflylimide as an Efficient Cationic Organocatalyst. In: Macromolecules. Band 43, Nr. 17, 2010, S. 7090–7094, doi:10.1021/ma100798u.
