3-Butensäure
3-Butensäure ist eine kurzkettige ungesättigte Carbonsäure. Sie ist eine hellgelbe, klare Flüssigkeit, deren Flammpunkt bei 65 °C liegt.[3]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
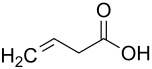 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Butensäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H6O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 86,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,01 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
163 °C[3] | ||||||||||||||||||
| pKS-Wert |
4,34 (25 °C)[4] | ||||||||||||||||||
| Löslichkeit |
mit Wasser vollständig mischbar[5] | ||||||||||||||||||
| Brechungsindex |
1,4239 (20 °C)[6] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Synthese
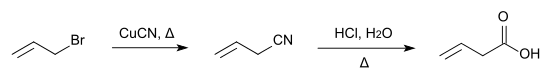
3-Butensäure kann durch Hydrolyse von Allylcyanid hergestellt werden,[8] das wiederum aus Allylbromid und Kupfer(I)-cyanid synthetisiert wird.[9]
Auch die Reaktion der entsprechenden Grignard-Verbindung mit Kohlendioxid liefert 3-Butensäure.[8]
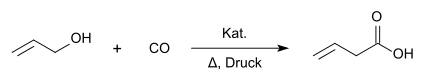
Die großtechnische Herstellung ist über eine katalytische Reaktion aus Allylalkohol und Kohlenmonoxid möglich.[10]
Reaktionen
3-Butensäure kann mit Lithiumaluminiumhydrid zu 3-Buten-1-ol reduziert werden.[11]
![]()
In der Dampfphase wird 3-Butensäure bei höheren Temperaturen zu Propen und Kohlendioxid decarboxyliert.[12]
Die Bromierung von 3-Butensäure mit elementarem Brom führt hauptsächlich zur 3,4-Dibrombutansäure, durch eine intramolekulare Kondensationsreaktion entsteht jedoch auch unter Abspaltung von Bromwasserstoff das entsprechende Lacton.[13]
Die Hydroformylierung von 3-Butensäure liefert grundsätzlich ein Isomerengemisch, jedoch kann durch die Wahl geeigneter Katalysatoren die Regioselektivität der Reaktion gesteuert werden.[14]

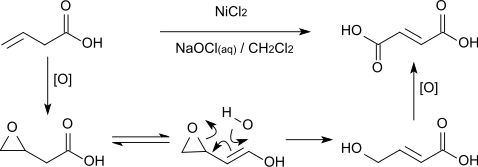
Mit Nickel(II)-chlorid und Natriumhypochlorit in Dichlormethan kann durch zweifache Oxidation Fumarsäure hergestellt werden.[15]
Mit Trinitromethan bildet sich 3-Methyl-4,4,4-Trinitrobuttersäure.[16]
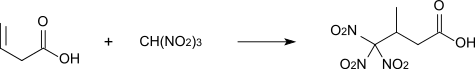
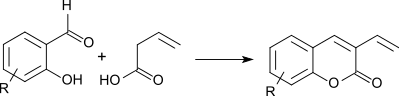
Die Kondensation von 3-Butensäure mit aromatischen 2-Hydroxyaldehyden liefert 3-Vinylcumarine.[17]
Auch mit Oximen finden unter geeigneten Bedingungen Cycloadditionen statt:[18]
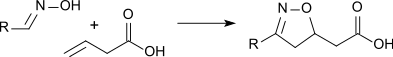
Einzelnachweise
- Datenblatt 3-Butensäure (PDF) bei Merck, abgerufen am 19. Mai 2010.
- Datenblatt 3-Butensäure bei Acros, abgerufen am 19. Mai 2010.
- Datenblatt 3-Butenoic acid bei Sigma-Aldrich, abgerufen am 22. Oktober 2016 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dissociation Constants of Organic Acids and Bases, S. 8-43.
- Datenblatt 3-Butensäure bei AlfaAesar, abgerufen am 19. Mai 2010 (PDF) (JavaScript erforderlich).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-74.
- Eintrag zu 3-Butensäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- E. Rietz: Vinylacetic acid In: Organic Syntheses. 24, 1944, S. 96, doi:10.15227/orgsyn.024.0096; Coll. Vol. 3, 1955, S. 851 (PDF).
- J. V. Supniewski, P. L. Salzberg: Allyl cyanide In: Organic Syntheses. 8, 1928, S. 4, doi:10.15227/orgsyn.008.0004; Coll. Vol. 1, 1941, S. 46 (PDF).
- Patent US4140865A: Process for the manufacture of vinyl acetic acid. Angemeldet am 12. März 1976, veröffentlicht am 20. Februar 1979, Anmelder: Hoechst AG, Erfinder: Hans Fernholz, Dieter Freudenberger.
- C. C. Lee, A. J. Cessna: Reactions of Cyclopropylcarbinol in dilute hydrochloric acid. In: Canadian Journal of Chemistry. 58, 1980, S. 1075–1079, doi:10.1139/v80-168.
- G. G. Smith, S. E. Blau: "Decarboxylation. I. Kinetic Study of the Vapor Phase Thermal Decarboxylation of 3-Butenoic Acid" in J. Phys. Chem. 1964, 68(5), S. 1231–1234. doi:10.1021/j100787a506
- K. Pels, V. Dragoljovic: Solvent-free phase-vanishing reactions with PTFE (Teflon) as a phase screen, in Beilstein Journal of Organic Chemistry 2009, 75(5). doi:10.3762/bjoc.5.75
- B. C. Gates: Advances in Catalysis. Academic Press, 2011, ISBN 0-12-387773-3, S. 80 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. M. Grill, J. W. Ogle, S. A. Miller: "An Efficient and Practical System for the Catalytic Oxidation of Alcohols, Aldehydes, and α,β-Unsaturated Carboxylic Acids" in J. Org. Chem. 2006, 71(25), S. 9291–9296. doi:10.1021/jo0612574
- L. T. Eremenko, V. I. Grigos: "Reaction of nitroform with vinylacetic acid" in Russian Chemical Bulletin 1967, 16(6), S. 1301–1302. doi:10.1007/BF00908296
- J. Gordo, J. Avo, A. J. Parola, J. C. Lima, A. Pereira, P. S. Branco: "Convenient Synthesis of 3-Vinyl and 3-Styryl Coumarins" in Organic Letters 2011, 13(19), S. 5112–5115. Volltext
- J. Wityak, C.-B. Xue, T. M. Sielecki-Dzurdz, R. E. Olson, W. F. Degrado, G. A. Cain: "Novel isoxazoline and isoxazole fibrinogen receptor antagonists", EP 0730590; EP 0832076; JP 1997505590; JP 1999504651; US 5849736; WO 9514683; WO 9638426. Volltext