ε-Caprolacton
ε-Caprolacton, auch ε-Lacton oder Caprolacton ist eine chemische Verbindung aus der Stoffgruppe der cyclischen Carbonsäureester, die als Lactone bezeichnet werden. Caprolacton hat einen siebengliedrigen Ring mit sechs C-Atomen, wie die dem Caprolacton zu Grunde liegende Hexansäure, die auch Capronsäure genannt wird.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
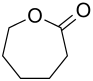 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | ε-Caprolacton | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C6H10O2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 114,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,08 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
235 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[2] | |||||||||||||||
| Brechungsindex |
1,463 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten |
5990 mg·kg−1 (LD50, Kaninchen, transdermal)[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Es sind eine ganze Reihe von Möglichkeiten zur Synthese von Caprolacton bekannt, die sich in zwei Gruppen aufteilen lassen. Zum Einen ist die Herstellung ausgehend von offenkettigen Verbindungen, wie z. B. Derivaten des Hexans möglich, zum Anderen die oxidative Ringerweiterung von cyclischen Ketonen.
Ausgehend von offenkettigen Verbindungen können beispielsweise 6-Hydroxyhexansäure[5], 1,6-Hexandiol[6] oder Adipinsäure[7] dienen.
Ausgehend von cyclischen Verbindungen kann Caprolacton durch eine Baeyer-Villiger-Oxidation von Cyclohexanon mit Persäuren, wie Peressigsäure[8], Perbenzoesäure[9] oder m-Chlorperbenzoesäure[10] hergestellt werden. Die Oxidation kann jedoch auch mittels Katalysatoren durch Sauerstoff bewerkstelligt werden.[11][12]
Eigenschaften
Caprolacton ist eine farblose Flüssigkeit, die bei −1,5 °C erstarrt und bei 235 °C siedet. Sie besitzt bei 20 °C eine dynamische Viskosität von 6,67 mPa‣s.[4] Ihr Flammpunkt beträgt 127 °C, ihre Zündtemperatur 204 °C.[4] Im Bereich von 1,2 bis 9 Volumenprozent bildet sie mit Luft explosive Gemische.[4] Bei Temperaturen über 220 °C beginnt sie sich zu zersetzen.[4]
Verwendung
Caprolacton dient als Grundstoff zur Herstellung von Polycaprolacton[5], einem Kunststoff aus der Gruppe der Thermoplasten.
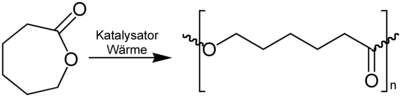
Herstellung von Polyestern aus ε-Caprolacton
Caprolacton kann leicht durch Lewis-Säuren oder Brønsted-Säuren geöffnet werden, was die Herstellung von Hexanderivaten ermöglicht.
Einzelnachweise
- Eintrag zu EPSILON-CAPROLACTONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- Eintrag zu epsilon-Caprolacton in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Datenblatt ε-Caprolactone bei Sigma-Aldrich, abgerufen am 26. April 2011 (PDF).
- Datenblatt ε-Caprolacton (PDF) bei Merck, abgerufen am 27. Februar 2010..
- F. J. van Natta, J. W. Hill, W. H. Carothers: Studies of Polymerization and Ring Formation. ε-Caprolactone and its Polymers, in: J. Am. Chem. Soc., 1934, 56, S. 455.
- W. Reppe: Äthinylierung VI, in: Liebigs Ann., 1955, 596, 1, S. 158–224.
- U. Matteoli, G. Menchi, M. Bianchi, P. Frediani, F. Piacenti: Gazzetta Chimica Italiana, 1985, 115, S. 603–606.
- P. S. Starcher, B. Phillips: Synthesis of Lactones, in: J. Am. Chem. Soc., 1958, 80, S. 4079–4082.
- S. L. Friess: Reactions of Per Acids. II. The Reaction of Perbenzoic Acid with Simple Cyclic Ketones. Kinetic Studies, in: J. Am. Chem. Soc., 1949, 71, S. 2571–2572.
- S. Horvat, P. Karallas, J. M. White: Reactions of β-trimethylstannylcyclohexanones with peracids: investigations into the stannyl-directed Baeyer–Villiger reaction, in: J. Chem. Soc., Perkin Trans. 2, 1998, 10, S. 2151–2154.
- C. Bolm, G. Schlingloff, K. Weickhardt: Use of molecular oxygen in the Baeyer-Villiger oxidation the influence of metal catalysts, in: Tetrahedron Letters, 1993, 34, S. 3405–3408.
- S.-I. Murahashi, Y. Oda, T. Naota: Fe2O3-catalyzed baeyer-villiger oxidation of ketones with molecular oxygen in the presence of aldehydes, in: Tetrahedron Letters, 1992, 33, S. 7557–7560.
