Vanadium(II)-bromid
Vanadium(II)-bromid ist eine chemische Verbindung der Elemente Vanadium und Brom. Es ist ein blass-orangebrauner, kristalliner Feststoff, der bei 800 °C siedet.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| _ V2+ _ Br− | ||||||||||
| Allgemeines | ||||||||||
| Name | Vanadium(II)-bromid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | VBr2 | |||||||||
| Kurzbeschreibung |
blassbrauner, kristalliner Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 210,75 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
3,23 g·cm−3[1] | |||||||||
| Siedepunkt |
800 °C[1] | |||||||||
| Löslichkeit |
löst sich in Wasser unter Bildung von [V(H2O)6]2+-Ionen[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Vanadium(II)-bromid kann durch Reduktion von Vanadium(III)-bromid mit Wasserstoff bei 400 °C gewonnen werden:[4]
Sie kann auch durch Bromierung von Vanadium gewonnen werden.[5]
Eigenschaften
Physikalische Eigenschaften
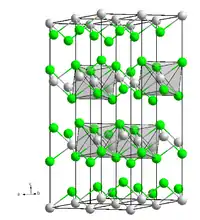
Vanadium(II)-bromid ist ein hellbrauner, in der Hitze rosaroter Feststoff. Er ist hygroskopischer als Vanadium(II)-chlorid, jedoch nicht so empfindlich wie Vanadium(III)-bromid. Mit Wasser bildet es eine violette Lösung, aus der blauviolette Nadeln des Hexahydrates isoliert werden können. Es besitzt eine oktaedrische Kristallstruktur, ähnlich der von Cadmiumiodid, mit der Raumgruppe P3m1 (Raumgruppen-Nr. 164) und den Gitterparametern a = 3,768 Å, c = 6,180 Å.[5][2]
Chemische Eigenschaften
Vanadium(II)-bromid ist ein starkes Reduktionsmittel, das sogar Stickstoff in Anwesenheit von Magnesiumhydroxid zu Hydrazin reduziert.[2]
Es löst sich in Wasser unter Bildung von [V(H2O)6]2+-Ionen:[2]
Einzelnachweise
- Vanadium(II)-bromid auf webelements.com
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1550.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Lothar Kolditz: Anorganische Chemie Teil 2. VEB Deutscher Verlag der Wissenschaften, Berlin 1980, S. 641.
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1413.