Rilpivirin
Rilpivirin (RLP) wurde von Tibotec entwickelt und ist ein Arzneistoff zur Behandlung HIV-infizierter Patienten im Rahmen einer HIV-Kombinationstherapie.[2]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
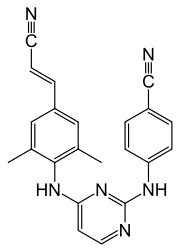 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Rilpivirin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C22H18N6 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkstoffklasse |
Virustatikum, nichtnukleosidische Reverse-Transkriptase-Inhibitoren | |||||||||||||||||||||
| Wirkmechanismus |
nicht-kompetitive Hemmung der reversen Transkriptase | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 366,42 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Rilvipivirin ist ein Diarylpyrimidin-(DAPY)-Analogon aus der Gruppe der nichtnukleosidischen Reverse-Transkriptase-Inhibitoren (NNRTI).
Gegenüber den NNRTIs der 1. Generation hat Rilpivirin den Vorteil, dass es auch gegen die meisten Stämme wirkt, bei denen diese NNRTIs versagen. Zusätzlich zeigen Studien deutlich weniger Nebenwirkungen des ZNS.[3] Vor diesem Hintergrund ist es wahrscheinlich, dass Rilpivirin – zusammen mit anderen NNRTI der 2. Generation (z. B. Etravirin) – die klassischen NNRTIs zukünftig ablösen könnte.
Zulassung als Medikament und Indikation
Rilpivirn wurde unter dem Handelsnamen Edurant im Mai 2011 von der FDA in den USA zugelassen, im November 2011 folgte die Zulassung für die EU.[2] Für die fixe Kombination mit Emtricitabin und Tenofovir als once-daily Therapieregime wurden Zulassungen unter den Namen Complera (USA, August 2011) und Eviplera (EU, November 2011) erteilt.[4][5]
Der Zusatznutzen von Rilpivirn aufgrund § 35a SGB V (AMNOG) (frühe Nutzenbewertung) wurde durch den Gemeinsamen Bundesausschuss (G-BA) bewertet:[6] Demnach liegt für Rilpivirn für antiretroviral nicht vorbehandelte erwachsene Patienten mit einer Viruslast von 100.000 HIV-1-RNA-Kopien/ml ein Beleg für einen geringen Zusatznutzen gegenüber der zweckmäßigen Vergleichstherapie (Etravirin) vor.[7] Für Rilpivirn wird der Zusatznutzen als gering eingestuft. Gegenüber der zweckmäßigen Vergleichstherapie handelt es sich um eine moderate Verbesserung des therapierelevanten Nutzens, da eine relevante Vermeidung dermatologischer und neurologischer Nebenwirkungen erreicht wird.[8] Die vorläufige Bewertung durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hatte einen höheren Zusatznutzen für das Monopräparat gesehen.[9][10]
Wechselwirkungen und Kontraindikationen
Rilpivirin darf nicht gleichzeitigf mit folgenden Wirkstoffen oder Medikamenten gegeben werden:
- Antikonvulsiva: Carbamazepin, Oxcarbazepin, Phenobarbital, Phenytoin,
- Tuberkulostatika: Rifabutin, Rifampicin, Rifapentin.
- Protonenpumpenhemmern: Omeprazol, Esomeprazol, Lansoprazol, Pantoprazol, Rabeprazol,
- Glucocorticoid: Dexamethason (außer bei Behandlung mit einer Einzeldosis)
- Johanniskraut (Hypericum perforatum)
Rilpivirn ist mit anderen HIV-Wirkstoffen unproblematisch kombinierbar.[11]
Nebenwirkungen
Eine seriöse Beurteilung der Nebenwirkungen und des Nebenwirkungenprofils ist bisher nicht möglich, da der Wirkstoff in wenigen Studien bisher nur an insgesamt etwa 1000 Patienten untersucht wurde und in der Praxis selten eingesetzt wird. Trotzdem wurde in Studien folgende Nebenwirkungen beobachtet:[12]
sehr häufig:
gering bis moderat ausgeprägt:
- Kopfschmerzen
- Übelkeit
- Leberwerterhöhung
- Erhöhung der Pankreas-Amylase
außerdem kam es häufig zu:
- generelle Blutbildveränderungen
- Schlafstörungen
- Schwindel
- gastrointestinalen Störungen
- Hautausschlag und Fatigu
Pharmakologie
Rilpivirin muss zusammen mit einer kalorienhaltigen Mahlzeit eingenommen werden, da sonst deutlich verschlechterte Resorption mit resultierend schlechterer Wirksamkeit.
Rilpivirin gehört zur Substanzklasse der nichtnukleosidischen Reverse-Transkriptase-Inhibitoren (NNRTI). Der Wirkstoff bindet nicht-kompetitiv an die Reverse Transkriptase von HIV-I, nahe der Substratbindungsstelle für Nukleoside. Dadurch wird die katalytisch aktive Bindungsstelle blockiert. Es können nur wenige Nukleoside binden und die Polymerisation wird deutlich verlangsamt.
Resistenzen
Gegenüber anderen NNRTIs hat Rilpivirin den Vorteil, dass es auch gegen die meisten Stämme wirkt, bei denen andere NNRTIs versagen.
Eine verminderte Plasmakonzentrationen (Wirkspiegel) von Rilpivirin könnte ein Versagen der HIV-Therapie bewirken, daher wird eine regelmäßige Kontrolle der Plasmakonzentrationen empfohlen.[13]
Pharmakokinetik
Rilpivirin unterliegt einer oxidativen Metabolisierung durch das Cytochrom P450-System der Leber (v. a. CYP3A4). Die terminale Halbwertszeit von 34 bis 55 Stunden erlaubt eine Einmalgabe pro Tag. Im Allgemeinen wird die maximale Plasmakonzentration nach oraler Einnahme innerhalb von 4–5 Stunden erreicht. Die gleichzeitige Einnahme von CYP3A4-Induktoren kann daher zu geringeren Plasmakonzentrationen von Rilpivirin führen, die in einem Verlust der therapeutischen Wirkung resultieren. Stoffe, die CYP3A4 hemmen, können zu erhöhten Plasmakonzentrationen von Rilpivirin führen. Ein erhöhter pH-Wert im Magen (z. B. durch Protonenpumpeninhibitoren) geht mit einer verminderten Bioverfügbarkeit einher.[14] Die Bioverfügbarkeit hängt insbesondere auch stark von der Nahrung ab: Bei Einnahme mit einem Proteindrink sinkt sie um 50 %, bei Einnahme ohne Nahrung sinkt sie um 40 %. Daher wird eine Einnahme 10 min nach einem Frühstück mit Brot, Butter, Marmelade und Käse/Schinken empfohlen.[13]
Literatur
- P. A. Janssen, P. J. Lewi, E. Arnold u. a.: In search of a novel anti-HIV drug: multidisciplinary coordination in the discovery of 4-[[4-[[4-[(1E)-2-cyanoethenyl]-2,6-dimethylphenyl]amino]-2- pyrimidinyl]amino]benzonitrile (R278474, rilpivirine). In: J Med Chem. 48, 2005, S. 1901–1909.
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 4-((4-((4-[(E)-2-Cyanoethenyl]- 2,6-dimethylphenyl)amino) pyrimidin-2-yl)amino) benzonitril im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. Juli 2020.
- Summary of the European public assessment report (EPAR) for Edurant der European Medicines Agency (EMA) (englisch)
- Pozniak 2007.
- Neu auf dem Markt – Rilpivirin, Pharmazeutischen Zeitung Online
- Gilead erhält europäische Marktzulassung für Eviplera®, ein neues, einmal täglich verabreichtes Kombipräparat in Form einer Einzeltablette für nicht vorbehandelte Erwachsene mit HIV-1-Infektion (Memento vom 7. Februar 2015 im Internet Archive), finanzen.net, 29. November 2011.
- Gemeinsamer Bundesausschuss: Frühe Nutzenbewertung (§ 35a SGB V).
- Gemeinsamer Bundesausschuss: Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Rilpivirin (PDF; 108 kB) vom 5. Juli 2012.
- Gemeinsamer Bundesausschuss: Beschlüsse über die Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V - Emtricitabin, Rilpivirin, Tenofovirdisoproxil (PDF; 112 kB) vom 5. Juli 2012.
- Rilpivirin bei HIV: Zusatznutzen für Monopräparat belegt, Pressemeldung Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG).
- Gemeinsamer Bundesausschuss: Arzneimittel-Richtlinie/ Anlage XII: Rilpivirin vom 5. Juli 2012.
- HIV-Medikamente - Rilpivirin - (Edurant®). Abgerufen am 15. Oktober 2020.
- Neu auf dem Markt: Rilpivirin. 16. Februar 2012, abgerufen am 15. Oktober 2020.
- Analysen-Spektrum - Rilpivirin, Labor Lademannbogen
- Zeynep Ofluoglu, Anke Heithoff, Ricarda Rockel-Witschonke, Nina Ciemniak, Ziba Mahdizadeh: Rilpivirin zur Behandlung von HIV-1-bei antiretroviral nicht vorbehandelten Erwachsenen. In: Förtbildungstelegramm Pharmazie. 6(6), 2012, S. 195–209.