Geobacteraceae
Die Geobacteraceae sind taxonomisch eine Familie prokaryotischer Mikroorganismen, die zur Domäne der Lebewesen Bacteria gehören.[1]
| Geobacteraceae | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

Geobacter sulfurreducens | ||||||||||
| Systematik | ||||||||||
| ||||||||||
| Wissenschaftlicher Name | ||||||||||
| Geobacteraceae | ||||||||||
| Holmes, Nevin & Lovley, 2004 |
Vorkommen
Geobacteraceae sind anaerob und werden hauptsächlich im Boden, in unterirdischen Habitaten sowie Süß- und Salzwassersedimenten angetroffen.[1][2]
Den Geobacteraceae werden auch hitze- bzw. kälteliebende Arten zugeordnet: Geothermobacter ehrlichii stammt von einer Hydrothermalquelle und kann noch bei 65 °C wachsen,[3] Geopsychrobacter electrodiphilus stammt aus Meeressediment und kann bei 4 °C immer noch wachsen.[4]
Systematik
Die Aufstellung der Geobacteraceae erfolgte auf der Grundlage von genetischen Vergleichen, vor allen der 16S-rRNA-Gene und anderer Gene (nifD, recA, gyrB, rpoB und fusA), die konservierten Genfamilien angehören und sich für einen solchen Vergleich eignen.[1]
Die Geobacteraceae gehören nach allgemein anerkannter Einteilung innerhalb der Bakterien zu den Proteobacteria, dort in die δ-Gruppe (Klasse Deltaproteobacteria) und in die Ordnung Desulfuromonadales. Dabei ist anzumerken, dass die Taxa oberhalb der Klasse, die Domäne Bacteria und das Phylum Proteobacteria, nach dem Regelwerk („Bakteriologischer Code“) der zuständigen internationalen Institutionen (IUMS und ICSP) keine offiziellen Taxa darstellen, während die Klasse (Proteobacteria), die Ordnung (Desulfuromonadales) und die Familie (Geobacteraceae) sowie Gattungen und Arten offizielle Taxa sind. Die aktuelle Zuordnung ist in der „Liste der prokaryotischen Namen mit ihrem Stand in der Nomenklatur“ (LPSN) einsehbar.[5]
Die Ordnung Desulfuromonadales hat zwei Familien, die hier behandelten Geobacteraceae und die Desulfuromonadaceae.
Nomenklatur der Familie Geobacteraceae
Zur Aufstellung der Familie Geobacteraceae gibt es zwei wirksame Veröffentlichungen, eine innerhalb und die andere außerhalb des IJSEM (International Journal of Systematic and Evolutionary Microbiology), die beide als gültig anerkannt worden sind:
- Holmes et al. (2004) – Direkt gültige Publikation zur neuen Familie innerhalb Geobacteraceae des entsprechenden Journals.[1]
- Garry et al. (2005) – Effektive Publikation zur Familie Geobacteraceae.[6]
- IUMS (2006) – Validierungsliste 107, unter anderem Gültigkeit des „neuen“ Namens Geobacteraceae Garry et al. 2006.[7]
Die als erstes anerkannte Autorenschaft hat Vorrang, daher heißt die Familie Geobacteraceae Holmes et al. 2004. Die Typgattung der Familie ist Geobacter Lovley et al. 1995.[1]
Gattungen und Arten
Die Geobacteraceae enthalten 24 Arten in fünf Gattungen (Abruf 2019-02[5][8]). Die Typgattung der Familie Geobacteraceae ist Geobacter Lovley et al. 1995 und zwar sowohl, wenn die zu bevorzugende (da früher erfolgte) Autorenschaft Geobacteraceae Holmes et al. 2004, angegeben wird, als auch bei der Alternative (spätere Autorenschaft Geobacteraceae Garrity et al. 2006).
Die Gattung Geobacter hat die Typart Geobacter metallireducens Lovley et al. 1995 und 18 weitere Arten.
Eine weitere Gattung (Geoalkalibacter Zavarzina et al. 2007) hat zwei Arten (Typart Geoalkalibacter ferrihydriticus Zavarzina et al. 2007) und drei weitere Gattungen (Geopsychrobacter Holmes et al. 2005; Geothermobacter Kashefi et al. 2005; Trichlorobacter De Wever et al. 2001) haben jeweils eine Art (Geopsychrobacter electrodiphilus Holmes et al. 2005; Geothermobacter ehrlichii Kashefi et al. 2005; Trichlorobacter thiogenes De Wever et al. 2001).
Physiologie
Die Eigenschaften, die ein Lebewesen aufweist, hängen mit der phylogenetischen Abstammungsverhältnissen zusammen, sind aber nicht deckungsgleich. Für die Familie Geobacteraceae lässt sich sagen, dass sie anaerobe Bewohner, vorzugsweise unterirdischer Lebensräume sind, in denen sie Mineralien, wie Eisen- und Schwefelverbindungen dissimilatorisch reduzieren können.[1][2] Diese Eigenschaften teilen sie mit vielen ihrer Verwandten (siehe Desulfuromonadales und Deltaproteobacteria).
Weiterhin können mehrere Geobacteraceae „mikrobielle Nanodrähte“ bilden und Syntrophien eingehen; diese Eigenschaften sind auch in anderen Gruppen entwickelt worden (siehe mikrobielle Nanodrähte und Syntrophien). Im Folgenden werden sie für die Geobacteraceae dargestellt.
Es gibt unter den Geobacteraceae Syntrophien, d. h., die Stoffwechselprodukte der einen Art sind die Nahrung einer anderen Art. Einige Arten haben einen besonders effektiven Mechanismus der Syntrophie entwickelt, den direkten Elektronentransport, der zuerst zwischen Geobacter metallireducens und Geobacter sulfurreducens beschrieben wurde.[9] Für diesen direkten Elektronentransport zwischen Arten (DIET, direct interspecies electron transfer) wachsen spezielle, fadenförmige Strukturen aus den Zellen, die mikrobiellen Nanodrähte oder elektrisch konduktiven Pili (E-Pili, Einzahl E-Pilus).[10] Es gibt verschiedene Vorstellungen und tatsächliche Wege, wie die Syntrophien durch DIET (also durch den direkten Elektronentransport zwischen verschiedenen Arten) bei anaeroben, prokaryotischen Mikroorganismen funktionieren.
Ueki et al. (2018)[10] haben diese Vorstellungen zusammen getragen, um sie für das bereits genannte Paar, Geobacter metallireducens und Geobacter sulfurreducens, zu prüfen:
- a) Beide Spezies besitzen E-Pili und Pili-assoziierte Multi-Häm-Cytochrome (Summers et al. 2010[11]) oder verwenden Pili-assoziiertes Magnetit (Liu et al. 2015[12]).
- b) Es befinden sich Ketten von Magnetit-Partikeln zwischen den Zellen (Kato et al. 2012[13]).
- c) Es findet ein Cytochrom-zu-Cytochrom-Transfer statt (McGlynn et al. 2015[14]).
- d) Leitfähiges Material dient als Verbindung für DIET (Liu et al. 2012[15]).
- e) Der elektronenspendende Partner stellt mit seinen E-Pili eine Verbindung zum elektronenakzeptierenden Partner her, der keine E-Pili aufweist (Rotaru et al. 2014[16][17]).
Ueki et al. haben für ihre Untersuchungen Mutanten verwendet, die strukturell normale E-Pili ausbilden, allerdings mit der Einschränkung, dass diese weniger leitfähig sind, als die Wildtyp-E-Pili. Es kam heraus, dass für das untersuchte Paar (G. metallireducens und G. sulfurreducens) Magnetit bzw. Cytochrome allein (ohne E-Pili) nicht ausreichen; es reicht nicht, dass nur der elektronenakzeptierende Partner E-Pili hat; es reicht aber für das Funktionieren des DIET schon aus, dass der Elektronendonator-Partner E-Pili hat (G. metallireducens), während der Elektronenakzeptor-Partner (G. sulfurreducens) diese nicht braucht [entspricht e)].
Syntrophie mit Methanbildnern
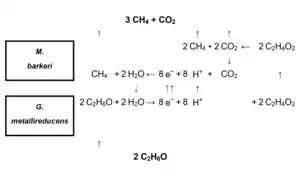
Interessant sind auch die Syntrophien zwischen den Geobacteraceae und den Methanbildnern (die zur Domäne der Lebewesen Archaea gehören[18]). Die Menge des gebildeten Methans durch Methanbildner wird durch die Anwesenheit von „Geobacteraceen“ und die Verfügbarkeit von Eisen(III)-Verbindungen beeinflusst.[19]
Eine gut untersuchte Beziehung ist die zwischen Geobacter metallireducens und Methanosarcina barkeri.[20] Der eine Partner (G. metallireducens) produziert eine Substanz, z. B. Essigsäure aus Ethanol, die der andere Partner (Methanosarcina barkeri) verbraucht. Die Oxidation des Ethanols zu Essigsäure durch G. metallireducens kann nur funktionieren, wenn ein geeigneter Elektronenakzeptor reduziert wird. G. metallireducens stellt aus Ethanol und Wasser Essigsäure und Protonen, sowie Elektronen für den direkten Elektronentransfer bereit (2 C2H6O + 2 H2O → 2 C2H4O2 + 8 H+ + 8 e−) und M. barkeri macht aus der Essigsäure Methan und Kohlendioxid (2 C2H4O2 → 2 CH4 + 2 CO2). Da die Elektronen dem direkten Elektronentransfer zwischen den Arten (DIET) zur Verfügung stehen, kann M. barkeri mit Protonen und den Elektronen und einem Teil des Kohlendioxids zusätzliches Methan herstellen (8 H+ + 8 e− + CO2 → CH4 + 2 H2O). Am Ende stellen G. metallireducens und M. barkeri gemeinsam aus Ethanol Methan und Kohlendioxid her (2 C2H6O → 3 CH4 + CO2), wobei keiner der beiden Partner ohne den anderen mit Ethanol allein etwas anfangen kann.[20]
Ökologie und Bedeutung
In den anaeroben Lebensräumen, in denen Geobacteraceae bevorzugt vorkommen,[1] können sie als Eisen(III)-Reduzierer oft durch eine erhöhte Eisen(III)-Verfügbarkeit (z. B. Eisen(III)-oxid) gefördert werden.[4][21] Andererseits sind sie durch ihre Fähigkeit zur Syntrophie in der Lage, die Oxidation von organischen Substanzen umzusetzen, indem sie ihrem Partner die Reduktion des terminalen Elektronenakzeptors überlassen (z. B.[10][20]). Ihre speziellen Fähigkeiten machen sie z. B. für die Bodenbeschaffenheit und Wasserqualität (Abbau organischer Stoffe), die Schadstoffumwandlung (Redoxreaktionen mit Chlorverbindungen und Schwermetallen) und die Energiegewinnung durch Methanproduktion (Syntrophie mit methanogenen Archaeen, siehe oben) und Elektrizität (direkte Übertragung von Elektronen) interessant. Auch Kombinationen sind denkbar, beispielsweise zur Methan- oder Elektrizitätsgewinnung durch den Abbau von Abfallstoffen.[22] Bei praktischen Anwendungen sind die passenden Konzentrationen fördernder[23] oder hemmender Stoffe,[22] bzw. die passende Temperaturen[24] oft entscheidende Größen. Die folgende Aufstellung enthält einige anwendungsorientierte Untersuchungen zu den Geobacteraceae.
Gemeinschaft mit Methanogenen
- Chen et al. (2014) – Die Förderung des Elektronentransfers zwischen den Spezies (DIET) mit Pflanzenkohle.[25]
- Zheng et al. (2015) – Das Co-Vorkommen von Methanosarcina mazei und Geobacteraceae in einer Eisen(III)-reduzierenden Anreicherungskultur.[26]
- Zhao et al. (2015) – Das Potenzial des direkten Interspezies-Elektronentransfer (DIET) in einem elektrischen, anaeroben System zur Steigerung der Methanproduktion aus der Schlammfaulung.[22]
- Zhang et al. (2017) – Die Verstärkung der Methanogenese durch direkten Interspezies-Elektronentransfer (DIET) zwischen Geobacteraceae und Methanosaetaceae durch granuläre Aktivkohle.[23]
Schadstoffumwandlung
- Holmes et al. (2002) – Die Anreicherung von Mitgliedern der Familie Geobacteraceae steht im Zusammenhang mit der Stimulierung der dissimilatorischen Metallreduktion in mit Uran kontaminierten Ablagerungen im Wasserleiter.[27]
- Cummings et al. (2003) – Die Diversität von Geobacteraceae-Arten, die in metallverschmutzten Süßwassersedimenten leben, wurde durch 16S-rDNA-Analysen ermittelt.[28]
- Lin et al. (2005) – Die Zusammensetzung der Geobacteraceae-Gemeinschaft hing mit der Hydrochemie und dem biologischen Abbau in einem eisenreduzierenden Aquifer zusammen, das durch eine benachbarte Deponie verschmutzt war.[29]
- O'Neil et al. (2008) – Gentranskriptanalyse zur assimilatorischen Eisenbegrenzung in Geobacteraceae während der Grundwasseraufbereitung.[30]
- Botton et al. (2007) – Die Dominanz von Geobacteraceae in Anreicherungen von Mikroben aus einem eisenreduzierenden Wasserleiter, die BTX (Benzol, Toluol, Xylol) abbauen.[31]
- Praveckova et al. (2016) – Ein indirekter Beweis verknüpft die Dehalogenierung von PCB (von polychlorierten Biphenylen) in anaeroben sedimentfreien Mikrokosmen mit den Geobacteraceae.[32]
- Bravo et al. (2018) – Die Geobacteraceae sind wichtige Mitglieder von quecksilbermethylierenden mikrobiellen Gemeinschaften in Sedimenten, die von Abwasser betroffen sind.[33]
Gewinnung elektrischer Energie
- Holmes et al. (2004) – Eine mögliche Rolle eines neuartigen psychrotoleranten Mitglieds der Familie Geobacteraceae, Geopsychrobacter electrodiphilus gen. nov., sp. nov., bei der Stromerzeugung durch eine Brennstoffzelle für marines Sediment.[24]
- Holmes et al. (2005) – Das Potenzial der Quantifizierung der Expression des Geobacteraceae-Citrat-Synthase-Gens zur Bestimmung der Aktivität von Geobacteraceae im Untergrund und an Elektroden zur Stromgewinnung.[34]
- Li et al. (2018) – Die verbesserte Redox-Leitfähigkeit und angereicherte Geobacteraceae in exoelektrogenen Biofilmen als Reaktion auf ein statisches Magnetfeld.[35]
Datenbanken
- LPSN, List of Prokaryotic names with Standing in Nomenclature, Stichwort Geobacteraceae – https://www.bacterio.net/family/geobacteraceae
- NCBI, National Center for Biotechnology Information, Taxonomy Browser, Stichwort Geobacteraceae – https://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?id=213422
Einzelnachweise
- D. E. Holmes, K. P. Nevin, D. R. Lovley: Comparison of 16S rRNA, nifD, recA, gyrB, rpoB and fusA genes within the family Geobacteraceae fam. nov. In: International journal of systematic and evolutionary microbiology. Band 54, Nummer 5, September 2004, S. 1591–1599, doi:10.1099/ijs.0.02958-0, PMID 15388715.
- Dawn E. Holmes, Regina A. O'Neil, Helen A. Vrionis, Lucie A. N'guessan, Irene Ortiz-Bernad, Maria J. Larrahondo, Lorrie A. Adams, Joy A. Ward, Julie S. Nicoll, Kelly P. Nevin, Milind A. Chavan, Jessica P. Johnson, Philip E. Long, Derek R. Lovley: Subsurface clade of Geobacteraceae that predominates in a diversity of Fe(III)-reducing subsurface environments. In: The ISME journal. Band 1, Nr. 8, 2007, ISSN 1751-7362, S. 663–677, doi:10.1038/ismej.2007.85, PMID 18059491.
- K. Kashefi, D. E. Holmes, J. A. Baross, D. R. Lovley: Thermophily in the Geobacteraceae: Geothermobacter ehrlichii gen. nov., sp. nov., a novel thermophilic member of the Geobacteraceae from the "Bag City" hydrothermal vent. In: Applied and Environmental Microbiology. Band 69, Nummer 5, Mai 2003, S. 2985–2993, PMID 12732575, PMC 154550 (freier Volltext).
- Dawn E. Holmes, Julie S. Nicoll, Daniel R. Bond, Derek R. Lovley: Potential Role of a Novel Psychrotolerant Member of the Family Geobacteraceae, Geopsychrobacter electrodiphilus gen. nov., sp. nov., in Electricity Production by a Marine Sediment Fuel Cell. In: Appl. Environ. Microbiol. Band 70, Nr. 10, 1. Oktober 2004, S. 6023–6030, doi:10.1128/AEM.70.10.6023-6030.2004.
- LPSN in Zusammenarbeit mit der Ribocon GmbH: Classification of domains and phyla - Hierarchical classification of prokaryotes (bacteria), Version 2.1. Updated 19 July 2018. In: LPSN, List of prokaryotic names with standing in nomenclature. J. P. Euzéby, Juli 2018, abgerufen im Februar 2019 (englisch).
- G. M. Garrity, J. A. Bell & T. Lilburn: Family II. Geobacteraceae fam. nov. In: D.J. BRENNER, N.R. KRIEG, J.T. STALEY & G. M. GARRITY (Hrsg.): Bergey's Manual of Systematic Bacteriology, second edition,. Volume two: (The Proteobacteria), part C (The Alpha-, Beta-, Delta-, and Epsilonproteobacteria). Springer-Verlag, New York 2005, ISBN 978-0-387-24145-6, S. 1017, doi:10.1007/978-0-387-29298-4.
- IUMS: Validation List No. 107: List of new names and new combinations previously effectively, but not validly, published. In: INTERNATIONAL JOURNAL OF SYSTEMATIC AND EVOLUTIONARY MICROBIOLOGY. 56, 2006, S. 499, doi:10.1099/ijs.0.64289-0.
- LPSN in Zusammenarbeit mit der Ribocon GmbH: Abruf der einzelnen Gattungen mit ihren Arten. In: LPSN, List of prokaryotic names with standing in nomenclature. J. P. Euzéby, abgerufen im Februar 2019 (englisch).
- Z. M. Summers, H. E. Fogarty, C. Leang, A. E. Franks, N. S. Malvankar, D. R. Lovley: Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria. In: Science. Band 330, Nummer 6009, Dezember 2010, S. 1413–1415, doi:10.1126/science.1196526, PMID 21127257.
- T. Ueki, K. P. Nevin, A. E. Rotaru, L. Y. Wang, J. E. Ward, T. L. Woodard, D. R. Lovley: Strains Expressing Poorly Conductive Pili Reveal Constraints on Direct Interspecies Electron Transfer Mechanisms. In: mBio. Band 9, Nummer 4, 07 2018, S. , doi:10.1128/mBio.01273-18, PMID 29991583, PMC 6050967 (freier Volltext).
- Z. M. Summers, H. E. Fogarty, C. Leang, A. E. Franks, N. S. Malvankar, D. R. Lovley: Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria. In: Science. Band 330, Nummer 6009, Dezember 2010, S. 1413–1415, doi:10.1126/science.1196526, PMID 21127257.
- F. Liu, A. E. Rotaru, P. M. Shrestha, N. S. Malvankar, K. P. Nevin, D. R. Lovley: Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange. In: Environmental microbiology. Band 17, Nummer 3, März 2015, S. 648–655, doi:10.1111/1462-2920.12485, PMID 24725505.
- S. Kato, K. Hashimoto, K. Watanabe: Microbial interspecies electron transfer via electric currents through conductive minerals. In: Proceedings of the National Academy of Sciences. Band 109, Nummer 25, Juni 2012, S. 10042–10046, doi:10.1073/pnas.1117592109, PMID 22665802, PMC 3382511 (freier Volltext).
- S. E. McGlynn, G. L. Chadwick, C. P. Kempes, V. J. Orphan: Single cell activity reveals direct electron transfer in methanotrophic consortia. In: Nature. Band 526, Nummer 7574, Oktober 2015, S. 531–535, doi:10.1038/nature15512, PMID 26375009.
- Fanghua Liu, Amelia-Elena Rotaru, Pravin M. Shrestha, Nikhil S. Malvankar, Kelly P. Nevin, Derek R. Lovley: Promoting direct interspecies electron transfer with activated carbon. In: Energy & Environmental Science. 5, 2012, S. 8982, doi:10.1039/c2ee22459c.
- Amelia-Elena Rotaru, Pravin Malla Shrestha, Fanghua Liu, Minita Shrestha, Devesh Shrestha, Mallory Embree, Karsten Zengler, Colin Wardman, Kelly P. Nevin, Derek R. Lovley: A new model for electron flow during anaerobic digestion: direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane. In: Energy Environ. Sci.. 7, 2014, S. 408, doi:10.1039/C3EE42189A.
- A. E. Rotaru, P. M. Shrestha, F. Liu, B. Markovaite, S. Chen, K. P. Nevin, D. R. Lovley: Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri. In: Applied and Environmental Microbiology. Band 80, Nummer 15, August 2014, S. 4599–4605, doi:10.1128/AEM.00895-14, PMID 24837373, PMC 4148795 (freier Volltext).
- George M. Garrity, John G. Holt, William B. Whitman, Jyoti Keswani, David R. Boone, Yosuke Koga, et al.: Phylum AII. Euryarchaeota phy. nov. In: David R. Boone, Richard W. Castenholz, George M. Garrity (Hrsg.): Bergey's Manual® of Systematic Bacteriology. Second edition Auflage. Volume one: The Archaea and the Deeply Branching and Phototrophic Bacteria. Springer Verlag, New York 2001, ISBN 978-0-387-98771-2, S. 211, doi:10.1007/978-0-387-21609-6_17.
- J. Ye, A. Hu, G. Ren, T. Zhou, G. Zhang, S. Zhou: Red mud enhances methanogenesis with the simultaneous improvement of hydrolysis-acidification and electrical conductivity. In: Bioresource Technology. Band 247, Januar 2018, S. 131–137, doi:10.1016/j.biortech.2017.08.063, PMID 28946086.
- A. E. Rotaru, P. M. Shrestha, F. Liu, B. Markovaite, S. Chen, K. P. Nevin, D. R. Lovley: Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri. In: Applied and Environmental Microbiology. Band 80, Nummer 15, August 2014, S. 4599–4605, doi:10.1128/AEM.00895-14, PMID 24837373, PMC 4148795 (freier Volltext).
- G. W. Zhou, X. R. Yang, C. W. Marshall, H. Li, B. X. Zheng, Y. Yan, J. Q. Su, Y. G. Zhu: Biochar Addition Increases the Rates of Dissimilatory Iron Reduction and Methanogenesis in Ferrihydrite Enrichments. In: Frontiers in Microbiology. Band 8, 2017, S. 589, doi:10.3389/fmicb.2017.00589, PMID 28428774, PMC 5382251 (freier Volltext).
- Z. Zhao, Y. Zhang, L. Wang, X. Quan: Potential for direct interspecies electron transfer in an electric-anaerobic system to increase methane production from sludge digestion. In: Scientific Reports. Band 5, Juni 2015, S. 11094, doi:10.1038/srep11094, PMID 26057581, PMC 4650609 (freier Volltext).
- Shuo Zhang, Jiali Chang, Chao Lin, Yiran Pan, Kangping Cui, Xiaoyuan Zhang, Peng Liang, Xia Huang: Enhancement of methanogenesis via direct interspecies electron transfer between Geobacteraceae and Methanosaetaceae conducted by granular activated carbon. In: Bioresource Technology. Band 245, Pt A, 2017, ISSN 1873-2976, S. 132–137, doi:10.1016/j.biortech.2017.08.111, PMID 28892682.
- Dawn E. Holmes, Julie S. Nicoll, Daniel R. Bond, Derek R. Lovley: Potential role of a novel psychrotolerant member of the family Geobacteraceae, Geopsychrobacter electrodiphilus gen. nov., sp. nov., in electricity production by a marine sediment fuel cell. In: Applied and Environmental Microbiology. Band 70, Nr. 10, 2004, ISSN 0099-2240, S. 6023–6030, doi:10.1128/AEM.70.10.6023-6030.2004, PMID 15466546.
- S. Chen, A. E. Rotaru, P. M. Shrestha, N. S. Malvankar, F. Liu, W. Fan, K. P. Nevin, D. R. Lovley: Promoting interspecies electron transfer with biochar. In: Scientific Reports. Band 4, Mai 2014, S. 5019, doi:10.1038/srep05019, PMID 24846283, PMC 4028902 (freier Volltext).
- Shiling Zheng, Hongxia Zhang, Ying Li, Hua Zhang, Oumei Wang, Jun Zhang, Fanghua Liu: Co-occurrence of Methanosarcina mazei and Geobacteraceae in an iron (III)-reducing enrichment culture. In: Frontiers in Microbiology. Band 6, 2015, ISSN 1664-302X, S. 941, doi:10.3389/fmicb.2015.00941, PMID 26441876, PMC 4562271 (freier Volltext).
- Dawn E. Holmes, Kevin T. Finneran, Regina A. O'Neil, Derek R. Lovley: Enrichment of members of the family Geobacteraceae associated with stimulation of dissimilatory metal reduction in uranium-contaminated aquifer sediments. In: Applied and Environmental Microbiology. Band 68, Nr. 5, 2002, ISSN 0099-2240, S. 2300–2306, PMID 11976101.
- D. E. Cummings, O. L. Snoeyenbos-West, D. T. Newby, A. M. Niggemyer, D. R. Lovley, L. A. Achenbach, R. F. Rosenzweig: Diversity of Geobacteraceae species inhabiting metal-polluted freshwater lake sediments ascertained by 16S rDNA analyses. In: Microbial Ecology. Band 46, Nr. 2, 2003, ISSN 0095-3628, S. 257–269, PMID 14708750.
- Bin Lin, Martin Braster, Boris M. van Breukelen, Henk W. van Verseveld, Hans V. Westerhoff, Wilfred F. M. Röling: Geobacteraceae community composition is related to hydrochemistry and biodegradation in an iron-reducing aquifer polluted by a neighboring landfill. In: Applied and Environmental Microbiology. Band 71, Nr. 10, 2005, ISSN 0099-2240, S. 5983–5991, doi:10.1128/AEM.71.10.5983-5991.2005, PMID 16204512, PMC 1266018 (freier Volltext).
- Regina A. O'Neil, Dawn E. Holmes, Maddalena V. Coppi, Lorrie A. Adams, M. Juliana Larrahondo, Joy E. Ward, Kelly P. Nevin, Trevor L. Woodard, Helen A. Vrionis, A. Lucie N'Guessan, Derek R. Lovley: Gene transcript analysis of assimilatory iron limitation in Geobacteraceae during groundwater bioremediation. In: Environmental Microbiology. Band 10, Nr. 5, 2008, ISSN 1462-2920, S. 1218–1230, doi:10.1111/j.1462-2920.2007.01537.x, PMID 18279349.
- Sabrina Botton, Marijn van Harmelen, Martin Braster, John R. Parsons, Wilfred F. M. Röling: Dominance of Geobacteraceae in BTX-degrading enrichments from an iron-reducing aquifer. In: FEMS microbiology ecology. Band 62, Nr. 1, 2007, ISSN 0168-6496, S. 118–130, doi:10.1111/j.1574-6941.2007.00371.x, PMID 17784862.
- Martina Praveckova, Maria V. Brennerova, Christof Holliger, Felippe De Alencastro, Pierre Rossi: Indirect Evidence Link PCB Dehalogenation with Geobacteraceae in Anaerobic Sediment-Free Microcosms. In: Frontiers in Microbiology. Band 7, 2016, ISSN 1664-302X, S. 933, doi:10.3389/fmicb.2016.00933, PMID 27379063, PMC 4909783 (freier Volltext).
- Andrea G. Bravo, Jakob Zopfi, Moritz Buck, Jingying Xu, Stefan Bertilsson, Jeffra K. SchaIndirekte efer, John Poté, Claudia Cosio: Geobacteraceae are important members of mercury-methylating microbial communities of sediments impacted by waste water releases. In: The ISME journal. Band 12, Nr. 3, 2018, ISSN 1751-7370, S. 802–812, doi:10.1038/s41396-017-0007-7, PMID 29321692, PMC 5864163 (freier Volltext).
- Dawn E. Holmes, Kelly P. Nevin, Regina A. O'Neil, Joy E. Ward, Lorrie A. Adams, Trevor L. Woodard, Helen A. Vrionis, Derek R. Lovley: Potential for quantifying expression of the Geobacteraceae citrate synthase gene to assess the activity of Geobacteraceae in the subsurface and on current-harvesting electrodes. In: Applied and Environmental Microbiology. Band 71, Nr. 11, 2005, ISSN 0099-2240, S. 6870–6877, doi:10.1128/AEM.71.11.6870-6877.2005, PMID 16269721, PMC 1287699 (freier Volltext).
- Cheng Li, Luguang Wang, Hong Liu: Enhanced redox conductivity and enriched Geobacteraceae of exoelectrogenic biofilms in response to static magnetic field. In: Applied Microbiology and Biotechnology. 2018, ISSN 1432-0614, doi:10.1007/s00253-018-9158-3, PMID 29923078.