Stickland-Reaktion
Eine Stickland-Reaktion ist die gekoppelte Gärung zweier verschiedener Aminosäuren bei gleichzeitiger Desaminierung, wobei eine Aminosäure oxidiert und die andere Aminosäure reduziert wird.[1] Diese Vergärungsart dient manchen Organismen als Energiequelle. Die Stickland-Reaktion ist eine Besonderheit bei der Vergärung von Aminosäuren. Der Stoffwechselweg verdankt den Namen seinen Entdecker Leonard Hubert Stickland.
| Übergeordnet |
| Aminosäureabbau |
| Gene Ontology |
|---|
| QuickGO |

Vorkommen
Organismen, die durch Sticklandreaktionen Energie gewinnen, sind typischerweise Vertreter aminosäureverwertender Clostridien im weiteren Sinne – eine polyphyletische Gruppe anaerober Bakterien innerhalb der Firmicutes. Typische Vertreter sind beispielsweise Clostridium sticklandii, C. sporogenes und C. botulinum. Da jedoch bis heute nur ein winziger Bruchteil aller Bakterien und Archaeen durch Isolate beschrieben und klassifiziert ist, ist natürlich nicht klar, ob Sticklandreaktionen nur auf wenige phylogenetische Gruppen beschränkt sind.
Biochemie
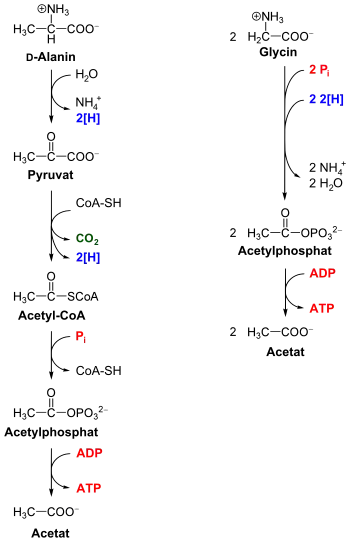
Stickland erkannte als erster, dass es Bakterien gibt, die nur Kombinationen aus zwei Aminosäuren vergären, hingegen diese Aminosäuren einzeln nicht verwerten.[2] Er fand, dass C. sporogenes (NCTC 533) sechs verschiedene Kombinationen in nennenswertem Umfang nutzt. Daher entstand für diese Art von Reaktionen der Überbegriff Stickland-Reaktion.
In den Stickland-Reaktionen gibt es jeweils zwei Äste:
Im oxidativen Ast wird die Aminosäure zu einer α-Ketosäure desaminiert. Diese wird anschließend unter Einbau von Coenzym A zu einer „aktivierten“ Fettsäure (Acyl-CoA) oxidativ decarboxyliert. Die energiereiche Thioesterbindung des Acyl-CoA wird mittels anorganischen Phosphats zu Acylphosphat erhalten. Der Phosphatrest des Acylphosphats wird schließlich auf Adenosindiphosphat (ADP) unter Bildung von Adenosintriphosphat (ATP) übertragen. Durch diese Substratkettenphosphorylierung wird im oxidativen Ast Energie gewonnen. Die ursprüngliche Kohlenstoffkette der Aminosäure ist nach der Vergärung um ein C-Atom kürzer.
Durch die reduktive Desaminierung der zweiten Aminosäure im reduktiven Ast werden die entstandenen Wasserstoff- bzw. Elektronenüberträger oxidiert und damit regeneriert. Aus der Aminosäure entsteht eine Fettsäure, wobei die Anzahl der Kohlenstoffatome erhalten bleibt.
Eine typische Stickland-Reaktion ist in der Abbildung am Beispiel von C. sporogenes gezeigt, das gleichzeitig D-Alanin oxidiert und zwei Moleküle Glycin reduziert.[2] Durch eine Aminotransferase wird Alanin zu Pyruvat desaminiert und α-Ketoglutarat zu L-Glutamat aminiert. Das Glutamat wird dann durch eine NAD+-abhängige Dehydrogenase wieder zu α-Ketoglutarat oxidiert, wobei NH4+ (Ammonium) freigesetzt wird. Manche Clostridien können Alanin auch durch eine NAD+-abhängige Alanindehydrogenase direkt zu Pyruvat oxidieren.[3]
Das entstandene Pyruvat wird durch eine Pyruvat-Ferredoxin-Oxidoreduktase mittels Coenzym A in Acetyl-CoA oxidativ decarboxyliert. Dabei wird Ferredoxin reduziert. Durch eine Phosphotransacetylase wird Acetyl-CoA zu Acetylphosphat[4] umgeestert. Dieses wird im Zuge der Substratkettenphosphorylierung zu Acetat umgesetzt, bei diesem Schritt entsteht ATP. Das an der Reaktion beteiligte Enzym ist eine Acetatkinase.
Im reduktiven Ast werden zwei Moleküle Glycin durch eine Selen- bzw. Selenocystein-enthaltende Glycinredukatase zu je zwei Molekülen Acetylphosphat umgesetzt. Aus diesen entsteht anschließend wie analog im oxidativen Ast Acetat, wodurch zusätzlich Energie gewonnen werden kann.[5]
Substratvielfalt
Neben Alanin können auch Methionin, Leucin, Isoleucin, Valin, Serin, Threonin und Histidin sowohl als Elektronenakzeptor als auch als Elektronendonor dienen. Im reduktiven Ast fungieren als Elektronenakzeptor neben Glycin auch Arginin, Leucin, Tryptophan, Phenylalanin, Tyrosin, Hydroxyprolin und Prolin.[6][7]
Auch nichtproteinogene Aminosäuren, wie beispielsweise D-Prolin, können genutzt werden, so dass eine enorme Vielzahl von Sticklandreaktionen denkbar ist, genutzt durch unterschiedliche Spezialisten. Jedoch nur im Falle von Glycin kann auch im reduktiven Ast über Acetylphosphat ATP gebildet werden.[5] Prolin wird nicht desaminiert, sondern durch eine Ringspaltung zu δ-Aminovalerat reduziert.[8]
Einzelnachweise
- Nisman, B. (1954): The Stickland Reaction. In: Bacteriol Rev 18(1): 16–42. PMID 13140081; PMC 180783 (freier Volltext, PDF).
- Stickland, LH. (1934): Studies in the metabolism of the strict anaerobes (genus Clostridium): The chemical reactions by which Cl. sporogenes obtains its energy. In: Biochem J. 28(5); 1746–1759. PMID 16745572; PMC 1253397 (freier Volltext, PDF).
- Nigel P. Minton (Hrsg.) und David J. Clarke (Hrsg.): Clostridia; Springer-Verlag; 2. Auflage 1989; ISBN 0-306-43261-7; S. 46.
- Acetylphosphat, Lexikon der Biologie; Acetylphosphat, Lexikon der Chemie. Auf spektrum.de.
- Andreesen, JR. (1994): Glycine metabolism in anaerobes. In: Antonie Van Leeuwenhoek. 66(1–3); 223–237; PMID 7747933; doi:10.1007/BF00871641.
- Georg Fuchs (Hrsg.), Hans. G. Schlegel (Autor): Allgemeine Mikrobiologie. 8. Auflage, Thieme Verlag, Stuttgart 2007; ISBN 3-13-444608-1; S. 374.
- Michael T. Madigan, John M. Martinko, Jack Parker und Thomas D. Brock: Mikrobiologie. Spektrum Akademischer Verlag, Heidelberg u. a. O. 2002, ISBN 3-8274-0566-1, S. 568.
- Stickland, LH. (1935): Studies in the metabolism of the strict anaerobes (Genus Clostridium): The reduction of proline by Cl. sporogenes. In: Biochem J. Bd. 29, Nr. 2, S. 288–290, PMID 16745669; PMC 1266487 (freier Volltext, PDF).
Literatur
- Georg Fuchs (Hrsg.), Hans. G. Schlegel (Autor): Allgemeine Mikrobiologie. 8. Auflage, Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1, S. 374.
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag, Stuttgart 2008; ISBN 978-3-13-144861-3; S. 385–386.
- Michael T. Madigan, John M. Martinko, Jack Parker und Thomas D. Brock: Mikrobiologie. Spektrum Akademischer Verlag, Heidelberg u. a. O. 2002, ISBN 3-8274-0566-1, S. 567–568.
- Wolfgang Fritsche: Mikrobiologie. 3. neubearb. Auflage, Spektrum Akademischer Verlag, Heidelberg 2002; ISBN 3-8274-1107-6, S. 250–251.