Sitagliptin
Sitagliptin ist ein oral wirksamer Arzneistoff zur Behandlung des Diabetes mellitus Typ 2. Es gehört zur Wirkstoffgruppe der Inhibitoren der Dipeptidylpeptidase 4 (auch Gliptine genannt), die neben den Inkretinmimetika auf der Wirkung des Glucagon-like Peptid 1 (GLP-1) beruhen. Sitagliptin wurde von MSD Sharp & Dohme entwickelt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Sitagliptin | |||||||||||||||||||||
| Andere Namen |
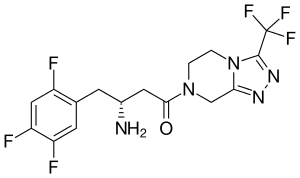
(R)-3-Amino-1-{3-(trifluormethyl)-5,6,7,8-tetrahydro[1,2,4]triazol[4,3-a]pyrazin-7-yl}-4-(2,4,5-trifluorphenyl)butan-1-on | |||||||||||||||||||||
| Summenformel | C16H15F6N5O | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A10BH01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 407,31 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wissenschaftliche Grundlagen
Wirkmechanismus
Die Wirkung von Sitagliptin beruht auf der Hemmung des Enzyms Dipeptidylpeptidase 4 (DPP-4), das für den Abbau des Hormons Glucagon-like Peptid 1 (GLP-1) verantwortlich ist. Da das von den L-Zellen der Darmschleimhaut gebildete GLP-1 die Freisetzung des blutzuckersenkenden Hormons Insulin anregt und die Sekretion des Insulin-Gegenspielers Glucagon reduziert, führt eine Hemmung der Dipeptidylpeptidase 4 durch Sitagliptin zu einer Senkung des Blutzuckerspiegels bei diabetischen Patienten. Die Wirkung des GLP-1 im Rahmen der Insulinantwort wird als Inkretin-Effekt bezeichnet.
Pharmakokinetik
Die maximale Plasmakonzentration nach Aufnahme von 100 Milligramm Sitagliptin wird beim erwachsenen Menschen nach ein bis vier Stunden erreicht. Die Plasmahalbwertzeit liegt bei rund zwölf Stunden. Für die absolute Bioverfügbarkeit nach oraler Aufnahme wurde ein Wert von 87 Prozent bestimmt. Die Bindung an Plasmaproteine ist mit rund 38 Prozent gering, das Gesamtverteilungsvolumen beträgt 198 Liter. Der mit 79 Prozent größte Teil der Substanz wird unverändert mit dem Urin ausgeschieden, nur ein kleiner Teil wird über Metabolisierungsreaktionen chemisch verändert. Hauptverantwortlich für die Metabolisierung sind die Cytochrom-P450-Enzyme CYP3A4 und CYP2C8.
Chemie
Der IUPAC-Name von Sitagliptin lautet (R)-7-[3-Amino-1-oxo-4-(2,4,5-trifluorphenyl)butyl]-5,6,7,8-tetrahydro-3-(trifluormethyl)-1,2,4-triazol[4,3-a]pyrazin. Der Feststoff liegt als Phosphat in Monohydratform vor und ist ein weißes, kristallines und nicht hygroskopisches Pulver. Die Summenformel der Verbindung ist C16H15F6N5O · H3PO4 · H2O, die molare Masse beträgt 523,32 g/mol. Sitagliptin ist löslich in Wasser, gering löslich in Methanol, sehr gering löslich in Ethanol, Aceton und Acetonitril und unlöslich in Isopropanol.
Der Green Presidential Award 2010 des US-Präsidenten wurde den Firmen MSD Sharp & Dohme und Codexis für die verbesserte grüne Synthese von Sitagliptin zugesprochen.[2] Sitagliptin weist in der Synthese eine schwierige stereoselektive Transaminierung eines Enamin auf. In der chemischen Synthese muss ein Kristallisationsschritt und eine bei 250 psi (≈17 bar) notwendige Hydrierung bei Einsatz eines Rhodiumkatalysators durchgeführt werden. In der enzymatisch katalysierten Reaktion wird diese Enaminreduktion durch eine Transaminierung eines Keton gelöst, das einfacher zugänglich ist. Durch Proteinmodellierung wurde eine optimierte Transaminase entwickelt, die um Faktor 25.000 effizienter als der Wildtyp war und stereoselektiv das (R)-Enantiomer des Sitagliptin biotransformierte. So konnte die Produktivität um 56 %, die Ausbeute um mehr als 10 % gesteigert und die Abfallmenge um 20 % reduziert werden.
Therapeutische Anwendung
Sitagliptin wird zur Behandlung des nicht-insulinpflichtigen Diabetes mellitus Typ 2 eingesetzt und beim erwachsenen Menschen im Regelfall einmal täglich in einer von der Nierenfunktion abhängigen Einzeldosis von 25 bis 100 Milligramm eingenommen. Es dient nicht vorrangig zur kurzfristigen Behandlung von Hyperglykämien oder zum gezielten Einsatz vor Mahlzeiten, sondern zur Verbesserung der körpereigenen Insulinantwort bei einer längerfristigen Behandlung.
Zulassungsstatus
Sitagliptin wurde im Oktober 2006 von der amerikanischen Arzneimittelzulassungsbehörde Food and Drug Administration (FDA) sowohl für eine Monotherapie als auch für die Anwendung in Kombination mit Metformin oder Glitazon zugelassen. Im März 2007 erteilte die Europäische Kommission die Genehmigung für das Inverkehrbringen in der Europäischen Union (EU), wo Sitagliptin für die orale Anwendung in Kombination mit Metformin oder einem Thiazolidin (Insulin-Sensitizer) zugelassen ist, seit 2008 bei Metformin-Unverträglichkeit auch in Kombination mit einem Sulfonylharnstoff.[3] Als bisher einziger DPP-4-Hemmer ist Sitagliptin auch in Monotherapie (bei Metformin-Unverträglichkeit), in Dreierkombination mit Metformin und Thiazolidin oder Sulfonylharnstoff sowie kombiniert mit Insulin (mit und ohne Metformin) zugelassen.[4][5][6]
Sitagliptin war die erste Substanz einer neuen Klasse von Wirkstoffen, die als Dipeptidyl-Peptidase-Hemmer oder DPP-4-Inhibitoren bezeichnet werden. Weitere Substanzen aus dieser Gruppe sind Vildagliptin, Saxagliptin und Alogliptin. Eine erhoffte protektive Wirkung auf das kardiovaskuläre System konnte bisher nicht gezeigt werden. Hinweise auf kardiale Risiken fanden sich im Gegensatz zu den Sulfonylharnstoffen und Glitazonen jedoch nicht.[7][8] DPP-4-Inhibitoren sind die zweite Wirkstoffgruppe neben den Inkretinmimetika, die auf dem Inkretin-Effekt beruhen.
Indikation und therapeutischer Nutzen
Sitagliptin wird zur Behandlung des Diabetes mellitus bei Patienten angewendet, bei denen mit Diät und Bewegung allein der Blutzucker nicht ausreichend gesenkt werden kann und Metformin ungeeignet ist.[9] Sitagliptin zur Therapie des Typ 2-Diabetes kommt als Alternative zur Insulintherapie in Betracht, wenn andere orale Antidiabetika in Mono- oder Kombinationstherapie versagen. Eine antidiabetische Sitagliptin-Monotherapie, primär bei einem neuentdeckten Diabetes oder sekundär bei Versagen anderer oraler Antidiabetika, ist zwar in den USA, nicht aber in Europa zugelassen.
In klinischen Studien zeigte sich, dass der Effekt von GLP-1 vom Blutzuckerspiegel abhängig ist. Da die Wirkung von Sitagliptin über das GLP-1 erfolgt, besteht bei einer Behandlung mit Sitagliptin im Gegensatz zu einigen bisher zugelassenen oral einzunehmenden antidiabetischen Medikamenten praktisch kein Risiko einer Unterzuckerung bei einer Überdosierung. Gegenüber dem Inkretin-Mimetikum Exenatid hat Sitagliptin für die Patienten den Vorteil, dass es nicht gespritzt werden muss, sondern in Tablettenform eingenommen werden kann.
Die für Exenatid beobachtete Senkung des Körpergewichts konnte für Sitagliptin nicht gezeigt werden. Andererseits kommt es bei einer Behandlung mit Sitagliptin auch nicht zu einer Gewichtszunahme, einer häufigen Begleiterscheinung mancher anderer oraler Antidiabetika. Darüber hinaus haben einige Studien Hinweise erbracht, dass die Dipeptidyl-Peptidase-Hemmer wie die Inkretin-Mimetika positive Effekte auf die insulinproduzierenden Betazellen in den Langerhansschen Inseln der Bauchspeicheldrüse haben und diese möglicherweise vor einem Funktionsverlust schützen beziehungsweise diesen hinauszögern. Die tatsächliche klinische Relevanz dieser Beobachtung ist jedoch unklar.
Studien mit harten klinischen Endpunkten, die eine langfristig schützende Wirkung des Medikaments belegen, liegen derzeit nicht vor.
Bei der Dossierbewertung der Gliptine gemäß Arzneimittelmarktneuordnungsgesetz (AMNOG) ist das IQWiG zu einem positiven Ergebnis („Zusatznutzen“) gekommen.[10]
Nebenwirkungen, Kontraindikationen und Interaktionen
Kontraindikationen sind Niereninsuffizienz, Schwangerschaft und Stillzeit. An häufigen Nebenwirkungen (1–10 % der Behandelten) traten Kopfschmerzen und Hypoglykämien auf, bei Letzterer in der Kombination mit Sulfonylharnstoffen (4,7 %–13,8 %) und Insulin (9,6 %).[4] Gelegentlich (1–10 ‰ der Behandelten) wurde von Schwindel, Verstopfung und Pruritus berichtet. Es gibt weitere Nebenwirkungen wie Erkrankungen der Haut oder der Skelettmuskulatur, jedoch ist die Häufigkeit nicht bekannt.[4] Für das Herzglykosid Digoxin zeigte sich ein leichter Anstieg des Plasmaspiegels bei gleichzeitiger Gabe mit Sitagliptin, für den allerdings im Normalfall keine Anpassung der Dosierung beider Medikamente empfohlen wird. Es sind Einzelfälle von akuter Pankreatitis beschrieben.[11]
Handelsnamen
Monopräparate
Januvia (D, A, CH), Tesavel (A), Xelevia (D, A, CH)
Kombinationspräparate
Mit Metformin: Efficib (A), Janumet (D, A, CH), Velmetia (D, A, CH)
Literatur
- D.J. Drucker, M.A. Nauck: The incretin system: glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes. In: The Lancet, 2006, Band 368, S. 1696–1705; PMID 17098089 doi:10.1016/S0140-6736(06)69705-5.
- Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 158 f.
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Sitagliptin
- MedlinePlus Drug Information: Sitagliptin (englisch)
- Fachinformation in USA für Januvia® 2014 (PDF; 254 kB; englisch)
Einzelnachweise
- Registrierungsdossier zu (3R)-3-amino-1-[3-(trifluoromethyl)-5,6-dihydro[1,2,4]triazolo[4,3-a]pyrazin-7(8H)-yl]-4-(2,4,5-trifluorophenyl)butan-1-one (Abschnitt GHS) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Juli 2020.
- EPA Information vom 10. August 2011 (engl.).
- Sitagliptin in Kombination mit Sulfonylharnstoff zugelassen. In: DAZ.online. 20. März 2008, abgerufen am 12. Mai 2017.
- Fachinformation Januvia(R), Februar 2016
- Fachinformation Galvus, Version Juni 2010.
- Fachinformation Onglyza, Version Februar 2011.
- William B. White, Christopher P. Cannon, Simon R. Heller, Steven E. Nissen, Richard M. Bergenstal, George L. Bakris, Alfonso T. Perez, Penny R. Fleck, Cyrus R. Mehta, Stuart Kupfer, Craig Wilson, William C. Cushman, Faiez Zannad: Alogliptin after Acute Coronary Syndrome in Patients with Type 2 Diabetes. In: New England Journal of Medicine. 2013, S. 130902030035004, doi:10.1056/NEJMoa1305889.
- Benjamin M. Scirica, Deepak L. Bhatt, Eugene Braunwald, P. Gabriel Steg, Jaime Davidson, Boaz Hirshberg, Peter Ohman, Robert Frederich, Stephen D. Wiviott, Elaine B. Hoffman, Matthew A. Cavender, Jacob A. Udell, Nihar R. Desai, Ofri Mozenson, Darren K. McGuire, Kausik K. Ray, Lawrence A. Leiter, Itamar Raz: Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus. In: New England Journal of Medicine. 2013, S. 130902030035004, doi:10.1056/NEJMoa1307684.
- Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 158 f.
- Gliptine: IQWiG bewertet nachgereichte Herstellerdaten. IQWiG, Pressemeldung, 1. Oktober 2013.
- Safety Information. FDA, 28. September 2009 (englisch).