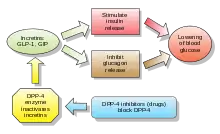
Inkretinmimetika
Inkretinmimetika oder GLP-1-Rezeptoragonisten sind Arzneistoffe zur Behandlung des Diabetes mellitus (Zuckerkrankheit), welche die Wirkung der körpereigenen Hormone Glukoseabhängiges insulinotropes Peptid (GIP) und Glucagon-like Peptid 1 (GLP-1) nachahmen, deren blutzuckersenkende Eigenschaften zusammenfassend als Inkretin-Effekt bezeichnet werden. GLP-1-Rezeptoragonisten werden als Injektion verabreicht.
Zur klinischen Wirksamkeit der Inkretinmimetika wurden 2011 zwei Metaanalysen aus insgesamt 21 randomisierten Vergleichsstudien mit einer Laufzeit von mindestens 20 Wochen zur Frage der Glucose- und Gewichtsreduktion veröffentlicht (Vilsbøll et al., 71. Jahrestagung der American Dietetic Association, 2011). Im Vergleich zu anderen Antidiabetika reduzierten die untersuchten GLP-1-Rezeptor-Agonisten Exenatid und Liraglutid den HbA1c-Wert im Mittel um 0,66 Prozent, die Gewichtsreduktion lag bei erwachsenen Menschen im Mittel bei 2,9 Kilogramm. Eine höhere Dosis Liraglutid führte zu einer stärkeren Gewichtsreduktion als die niedrige Dosis. Kein Unterschied zeigte sich zwischen der täglichen und der einmal wöchentlichen Gabe von Exenatid. Als Nebeneffekte zeigten sich eine leichte Blutdrucksenkung und eine Senkung des Gesamtcholesterins. Liraglutid ist in den USA seit Dezember 2014 unter dem Handelsnamen Saxenda zur täglichen Injektion gegen Übergewicht zugelassen.
Eine weitere Klasse von Arzneistoffen, deren Wirkung ebenfalls auf dem Inkretin-Effekt beruht, sind die Inhibitoren der Dipeptidylpeptidase 4, die ein Enzym hemmen, durch das GLP-1 nach seiner Freisetzung abgebaut wird.
Unerwünschte Arzneimittelwirkungen
Die wesentlichen Nebenwirkungen sind Übelkeit, Durchfall und Erbrechen.[1] Es liegen keine Daten dazu vor, ob Inkretinmimetika Folgen des Diabetes wie Amputationen, Erblindung und Nierenversagen verhindern können. Die GLP-1-basierten Therapien könnten jedoch, wie in einer Autopsiestudie an Diabetes-Patienten festgestellt wurde, das Pankreas negativ beeinflussen.[2] Sowohl die amerikanische Arzneimittelzulassungsbehörde FDA als auch die Europäische Arzneimittel-Agentur haben 2013 deswegen entsprechende Untersuchungen angekündigt.[3][4]
Gegenanzeigen
Zu den Kontraindikationen gehört die schwere Niereninsuffizienz. Bei eingeschränkter Leberfunktion wurde Liraglutid nicht empfohlen.[5]
Arzneistoffe mit Zulassung
- Exenatid: Das synthetisch hergestellte Polypeptid Exenatid, das der natürlicherweise im Speichel der Gila-Krustenechse vorkommenden Substanz Exendin-4 entspricht und in Struktur und Wirkung dem GLP-1 ähnelt, ist das erste auf dem Arzneimittelmarkt erhältliche Inkretinmimetikum. Es stellt damit die Leitsubstanz dieser neuen Wirkstoffklasse dar. Exenatid (Handelsname Byetta) erhielt im April 2005 die Zulassung der amerikanischen Food and Drug Administration (FDA) für die Anwendung in Kombination mit Metformin oder Glitazonen. Unter dem Handelsnamen Bydureon ist eine Retardformulierung zur wöchentlichen Anwendung verfügbar.
-3129.jpg.webp) Autoinjektor mit Dulaglutid
Autoinjektor mit Dulaglutid - Liraglutid: Im Juli 2009 wurde von der Europäischen Arzneimittelagentur das von Novo Nordisk entwickelte Liraglutid (Handelsname Victoza) zur Behandlung des Diabetes mellitus Typ 2 bei Erwachsenen[6] zugelassen, bei dem es sich um ein Analogon des menschlichen GLP-1 handelt, dessen Wirkdauer auf 24 Stunden verlängert wurde. Unter dem Namen Saxenda ist es zur Gewichtsregulierung bei Übergewicht zugelassen. Unter dem Namen Xultophy gibt es eine Kombination aus Liraglutid und Insulin degludec.[7]
- Albiglutid (Handelsname Eperzan) von GlaxoSmithKline ist in Deutschland seit Oktober 2014 im Handel. Es hat die Zulassung zur Monotherapie bei Erwachsenen mit Typ-2-Diabetes, wenn Diät und Bewegung allein zur Blutzuckereinstellung nicht ausreichen und wenn die Anwendung von Metformin nicht in Frage kommt. Albiglutid wird als wöchentliche Injektion verabreicht.
- Dulaglutid (Handelsname Trulicity) von Lilly ist in Deutschland seit Februar 2015 im Handel. Üblich ist ebenfalls die wöchentliche Injektion, wobei die Dosierung vom individuellen Blutzucker abhängig gemacht werden kann.
- Semaglutid: Der eng verwandte Nachfolger von Liraglutid, wurde – als erster GLP-1-Rezeptor-Agonist – zur Darreichung in Tablettenform (oral) entwickelt, dann aber 2018 ebenfalls zur subkutanen Injektion auf den Markt gebracht.
Substanzen ohne Zulassung
- Taspoglutid: Das von Roche entwickelte GLP1-Analogon befand sich Ende 2009 in den Phase-III-Studien, die Markteinführung wurde für 2011 oder 2012 erwartet. Im September 2010 gab Roche bekannt, dass alle Studien mit Taspoglutid abgebrochen wurden. Grund hierfür waren teils schwere allergische Reaktion sowie häufige Nebenwirkungen im Magen-Darm-Trakt, hauptsächlich Übelkeit und Erbrechen.[8]
- Lixisenatid (ehemaliger Handelsname Lyxumia) kam in Deutschland im Mai 2014 auf den Markt, wurde jedoch im Juni 2014 wieder aus dem Handel genommen.
- Pseudin-2: Als ein weiterer möglicher Wirkstoff wurde das aus dem Hautsekret des Großen Harlekinfrosches (Pseudis paradoxa) isolierte Pseudin-2 identifiziert.
Literatur
- J. J. Neumiller: Differential chemistry (structure), mechanism of action, and pharmacology of GLP-1 receptor agonists and DPP-4 inhibitors. In: Journal of the American Pharmacists Association. 49 Suppl 1, 2009, S. 16–29, doi:10.1331/JAPhA.2009.09078, PMID 19801361.
- F. Svec: Incretin physiology and its role in type 2 diabetes mellitus. In: The Journal of the American Osteopathic Association. 110, Nr. 7 Suppl 7, Juli 2010, S. eS20–24. PMID 20644202.
- S. Grossman: Differentiating incretin therapies based on structure, activity, and metabolism: focus on liraglutide. In: Pharmacotherapy. Band 29, 12 Pt 2, 2009, S. 25S–32S, doi:10.1592/phco.29.pt2.25S, PMID 19947814.
- Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 162–165.
Einzelnachweise
- Metaanalysen zu GLP-1-Mimetika, B. Wilms, Congress-Report Dezember 2011, S. 21f.
- A. E. Butler, M. Campbell-Thompson, T. Gurlo, D. W. Dawson, M. Atkinson, P. C. Butler: Marked Expansion of Exocrine and Endocrine Pancreas with Incretin Therapy in Humans with increased Exocrine Pancreas Dysplasia and the potential for Glucagon-producing Neuroendocrine Tumors. In: Diabetes. Band 62, S. 2595–2604, doi:10.2337/db12-1686.
- EMA: European Medicines Agency investigates findings on pancreatic risks with GLP-1-based therapies for type-2 diabetes (PDF; 92 kB).
- FDA investigating reports of possible increased risk of pancreatitis and pre-cancerous findings of the pancreas from incretin mimetic drugs for type 2 diabetes.
- Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 2015, S. 162–165.
- Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 10. Auflage. Kitteltaschenbuch, Sinsheim 2015, ISBN 978-3-00-050903-2, S. 162.
- Richard Daikeler, Götz Use, Sylke Waibel: Diabetes. Evidenzbasierte Diagnosik und Therapie. 2015, S. 165.
- medpageTODAY, Medical News, Roche Halts Trials of Taspoglutide, 13. September 2010, abgerufen am 10. Oktober 2010.