Dipeptidylpeptidase 4
Das proteolytische Enzym Dipeptidylpeptidase 4 (Kurzformen: DPP 4, auch DPP IV, DP IV) wird den Exopeptidasen zugeordnet. Es ist ein Oberflächenprotein und spaltet am N-Terminus eines Peptides Dipeptide ab. DPP4 ist der Rezeptor für MERS-CoV.[1]
| Dipeptidylpeptidase 4 | ||
|---|---|---|
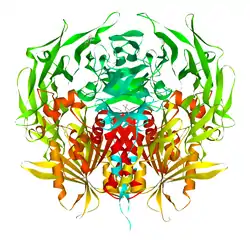 | ||
| Bändermodell nach PDB 1PFQ | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 766 / 728 Aminosäuren | |
| Sekundär- bis Quartärstruktur | löslich / single pass Typ 2 Membranprotein; Homodimer; Heterodimer | |
| Bezeichner | ||
| Gen-Namen | DPP4 ; ADABP; ADCP2; CD26; DPPIV; TP103 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.14.5, Serinprotease | |
| MEROPS | S09.003 | |
| Reaktionsart | Hydrolyse, spaltet Dipeptide vom N-terminalen Ende eines Peptides ab | |
| Substrat | Oligopeptide und auch Polypeptide (bevorzugt Peptide mit Prolinresten in der P1-Position) | |
| Produkte | kürzere Peptide + Dipeptide | |
| Vorkommen | ||
| Homologie-Familie | Dipeptidylpeptidase 4 | |
| Übergeordnetes Taxon | Lebewesen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 1803 | 13482 |
| Ensembl | ENSG00000197635 | ENSMUSG00000035000 |
| UniProt | P27487 | P28843 |
| Refseq (mRNA) | NM_001935 | NM_001159543 |
| Refseq (Protein) | NP_001926 | NP_001153015 |
| Genlocus | Chr 2: 161.99 – 162.07 Mb | Chr 2: 62.33 – 62.41 Mb |
| PubMed-Suche | 1803 | 13482 |
Historie
Das Enzym wurde erstmals 1966 von Hopsu-Havu und Glenner beschrieben und als Dipeptid-Naphthylamidase bezeichnet.[2] Unabhängig davon wurde das Enzym 1974 von Horst Schulz und Alfred Barth wiederentdeckt und im Ergebnis diverser Untersuchungen zum Chemismus als Dipeptidylpeptidase IV [DP IV] bezeichnet.[3]
Wirkungen
Die Abspaltung der Dipeptide findet bevorzugt statt, wenn sich an zweiter Stelle der Aminosäuresequenz ein Prolin- oder Alaninrest befindet. Wenn an dritter Stelle der Aminosäuresequenz ein Prolinrest steht, wird das Peptid jedoch nicht angegriffen. Jaron (Israel) stellte eine Reihe biologisch aktiver Peptide vor, die als potentielle Substrate der DP IV fungieren können.[4] Sie alle haben die N-terminale Sequenz AS-Pro-…. Einige dieser Substanzen wurden experimentell geprüft und sie konnten als Substrate der Dipeptidylpeptidase 4 bestätigt werden. Dabei stellte sich heraus, dass deren katalytische Hydrolyse (Spaltung) ihre biologische Wirkung aufhebt, mindert oder verstärkt oder dass sich eine biologische Wirkung aus einem inaktiven Präkursor ausbildet oder dass keine Spaltung durch DP IV erfolgt. Dazu einige Beispiele:
GLP-1
Das intestinale Peptidhormon GLP-1(7-39) wird durch die DP IV inaktiviert. Das Abbauprodukt GLP-1(9-39) wirkt als funktioneller GLP-1-Rezeptor-Antagonist.
PYY
Gegensätzlich zu GLP-1 wird PYY durch die DP IV aktiviert. Erst durch die hydrolytische Abspaltung eines Dipeptids vom Prohormon entsteht das bioaktive PYY.
Casomorphine
Die Casomorphine sind kurzkettige Peptide, die erstmals aus dem β-Casein der Kuhmilch gewonnen wurden (Henschen, Brantl und Teschemacher, Max-Planck-Institute Martinsried und München). Sie sind in der Sequenz des Proteins enthalten und können aus ihm isoliert werden. Es handelt sich bei den Rinder-Casomorphinen um ein Heptapeptid und ein Pentapeptid. Beide Verbindungen haben physiologisch eine opioide Aktivität (etwa 4 % der des Morphins). Das Pentapeptid entsteht aus dem Heptapeptid durch C-terminale Sequenzverkürzung mittels Carboxypeptidase Y. β-Casomorphin-5 wird durch Dipeptidylpeptidase 4 weiterhin schrittweise abgebaut und dabei inaktiviert:[5]
- β-Casomorphin-5: Tyr-Pro-Phe-Pro-Gly
Einige Abkömmlinge des β-Casomorphin-5 zeigen eine höhere opioide Aktivität im Vergleich zu Morphin (icv-appliziert). Bei den Des-Tyr-Derivaten dieser Verbindungen ist keine opioide Wirksamkeit mehr vorhanden, an ihrer Stelle tritt aber eine neuroleptische Aktivität in den Vordergrund.
Substanz P
Die physiologisch aktive Substanz P wird durch DP IV limitierend hydrolysiert. Dabei kommt es zu einer messbaren Aktivitätserhöhung.[6]
- Substanz P: Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met-NH2
Melittin
Sehr interessant sind Arbeiten der Gruppe um Kreil aus Salzburg, das Gift der Honigbiene betreffend. Aus einem Vorläuferpeptid (Promelittin) wird durch Dipeptidylpeptidase 4 das Bienengift Melittin freigesetzt, indem Schritt für Schritt 10 Dipeptide der Sequenz AS-Pro und AS-Ala abgespalten werden:[7]
- Promelittin: Ala-Pro-Glu-Pro-Glu-Pro-Ala-Pro-Glu-Pro-Glu-Ala-Glu-Ala-Asp-Ala-Glu-Ala-Asp-Pro-Glu-Ala-Melittin
Bradykinin
Bradykinin ist trotz der N-terminalen Arg-Pro-Sequenz nicht durch DP IV hydrolysierbar, da in AS3-Position ein Pro steht.[8]
- Bradykinin: Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg
Inhibitoren
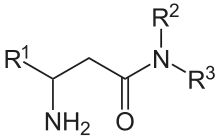
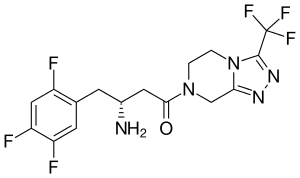
Durch Hemmung der katalytischen Aktivität der Dipeptidylpeptidase 4 ist es möglich, die Wirkung dieses Enzyms auszuschalten. Dies führt zur Forderung nach der Entwicklung effektiver und spezifischer Inhibitoren der Dipeptidylpeptidase 4. Grundsätzlich sind die Spaltprodukte der Enzymwirkung potentielle Enzymhemmer, insbesondere die Verbindungen AS-Pro. Effektiver sind die decarboxylierten Derivate, also die AS-Pyrrolidide. Kürzlich sind die β-Aminoacylamide interessant geworden. Insbesondere Sitagliptin wurde im Oktober 2006 in den USA als Wirkstoff gegen Diabetes Typ II zugelassen, und als Arzneistoff unter dem Handelsnamen Januvia vertrieben. Das Hormon Glucagon-like Peptid 1 (GLP-1) regt die Freisetzung des Insulins an. Des Weiteren blockiert es die Freisetzung des Hormons Glukagon, welches im Glucosestoffwechsel zur Erhöhung des Glucosespiegels im Blut führt. Dipeptidylpeptidase 4 baut GLP-1 ab. Inhibitoren der DP IV verhindern diesen Abbau und bewirken damit die Förderung der Insulinfreisetzung indirekt, ebenso wie die reduzierte Bildung von Glucose auf dem Weg der Gluconeogenese. Da dieser Mechanismus im Darm abläuft, ist eine orale Applikation möglich.
Studien zeigten, dass die Substanz εZ(4-NO2)-Lys-Pro eine die Wundheilung fördernde Wirkung besitzt, verbunden mit einer Stimulation der Bildung von Granulationsgewebe. Die Verbindung εZ(4-NO2)-Lys-Pro ist ein Dipeptidylpeptidase-4-Inhibitor. Ein kausaler Zusammenhang zwischen wundheilungsfördernder Wirksamkeit und der DP IV-Hemmung führt zu der Schlussfolgerung: Die differenten kurativen Effekte werden zwar durch identische Rezeptoren (DP IV) ausgelöst, sie sind jedoch eine Folge unterschiedlicher Applikationsorte (bei den DP IV–Hemmern als Pharmaka gegen Diabetes Typ 2 erfolgt eine orale Anwendung in Tablettenform über den Darm. Im Gegensatz dazu wird bei der Wundheilung der Applikationsort durch die zu behandelnde Wunde bestimmt.).[9]
2010 veröffentlichte Untersuchungen zeigten, dass die CD26 (DP IV-Protein) nicht unbedingt direkt mit der HIV-Infektion verknüpft ist, aber sie ist an der Reduktion der Immunantwort bei der AIDS-Krankheit beteiligt.[10] Im Jahre 2012 wurde berichtet, dass die CD26/DP4 im Maus-Modell eine mit hoher Wahrscheinlichkeit schützende Funktion bei Atemwegsentzündungen (z. B. allergisches Asthma) hat.[11]
PETIR (Peptidase Target Immune Regulation) ist eine Forschungsplattform zur Entwicklung von Therapeutika für die Behandlung von chronischen Entzündungen, Allergien und Autoimmunerkrankungen. PETIR-Therapeutika sind Strukturen, die die Eigenschaften der Hemmung der beiden Zielenzyme Dipeptidylpeptidase IV und Aminopeptidase N in einer einzigen niedermolekularen chemischen Verbindung vereinen.[12] Durch Hemmung der Zielenzyme wird eine hocheffektive Verringerung der allgemeinen inflammatorischen Reaktion initiiert, die auf der gleichzeitigen Senkung des Aktivierungszustandes chronisch aktivierter Immunzellen und der parallelen Reaktivierung der immunsuppressiven regulatorischer T-Zellen beruht. Entsprechende Therapeutika werden für die lokale Therapie mittelschwerer und schwerer Formen der Acne vulgaris entwickelt. Das Präparat IP10.C8 beeinflusst sowohl Wachstum und Differenzierung von Sebozyten als auch Keratinocyten und ist ein sehr potenter Hemmer der lokalen Entzündungsreaktion. Darüber hinaus wirkt die Substanz gegenüber Propionibacterium acnes bakteriostatisch und stellt durch den parallelen Angriff dieser Hauptpathogenitätsfaktoren eine Alternative zu den derzeitigen Behandlungsmöglichkeiten der Akne dar.
Studien zeigen, dass Erkrankungen wie Alzheimer, Arteriosklerose, und Multipler Sklerose im Stoffwechsel Schlüsselenzyme besitzen, nämlich die Glutaminyl-Cyclase (QC) und die iso-Glutaminyl-Cyclase (isoQC), diese verhindern durch einen Pyroglutamat-Ringschluss die katalysierte Abspaltung der N-terminalen Glutaminsäure durch Aminopeptidasen bzw. die Eliminierung des Dipeptids Glu-Pro aus den Substraten durch Dipeptidylpeptidase IV.[13]
Wesentliche Rollen der DP IV
- Inhibitoren der DP IV sind Arzneimittel gegen Diabetes Typ 2
- Inhibitoren der DP IV fördern die Wundheilung
- Die DP IV ist an der Immunschwäche bei AIDS beteiligt
- Bifunktionelle Inhibitoren sind Entzündungshemmer und Pharmaka gegen Akne
- Die DP IV ist am Mechanismus bei der Alzheimer-Krankheit, Arteriosklerose und Multipler Sklerose beteiligt
- Die DP IV besitzt eine schützende Funktion gegenüber Atemwegsentzündungen (allergisches Asthma)
Literatur (Auswahl)
- Küllertz G, Fischer G, Barth A: [Catalytic mechanism of dipeptidyl-peptidase IV]. In: Acta Biol. Med. Ger.. 37, Nr. 4, 1978, S. 559–67. PMID 735626.
- Barth, A., Neubert, K., Schwarz, G., Fischer, G., Dove, S., Franke, R: Enzymatic Hydrolyses of Alanyl-alanine-anilides by Dipeptidyl Peptidase IV. In: Seydel, J. K. (Hrsg.): QSAR and Strategies in the Design of Bioactive Compounds. Proceedings of the 5th European Symposium on QSAR. Verlag Chemie, Weinheim 1985, ISBN 3-527-26306-3, S. 318–21.
- Brandt W, Lehmann T, Thondorf I, et al.: A model of the active site of dipeptidyl peptidase IV predicted by comparative molecular field analysis and molecular modelling simulations. In: Int. J. Pept. Protein Res.. 46, Nr. 6, Dezember 1995, S. 494–507. PMID 8748710.
- Tulinsky A, Blevins RA: Structure of a tetrahedral transition state complex of alpha-chymotrypsin dimer at 1.8-A resolution. In: J. Biol. Chem.. 262, Nr. 16, Juni 1987, S. 7737–43. PMID 3584139.
- Mace JE, Agard DA: Kinetic and structural characterization of mutations of glycine 216 in alpha-lytic protease: a new target for engineering substrate specificity. In: J. Mol. Biol.. 254, Nr. 4, Dezember 1995, S. 720–36. doi:10.1006/jmbi.1995.0650. PMID 7500345.
- Stoll VS, Eger BT, Hynes RC, Martichonok V, Jones JB, Pai EF: Differences in binding modes of enantiomers of 1-acetamido boronic acid based protease inhibitors: crystal structures of gamma-chymotrypsin and subtilisin Carlsberg complexes. In: Biochemistry. 37, Nr. 2, Januar 1998, S. 451–62. doi:10.1021/bi971166o. PMID 9425066.
- Brandt W, Lehmann T, Hofmann T, Schowen RL, Barth A: The probable conformation of substrates recognized by dipeptidyl-peptidase IV and some aspects of the catalytic mechanism derived from theoretical investigations. In: J. Comput. Aided Mol. Des.. 6, Nr. 2, April 1992, S. 159–74. PMID 1352539.
- Ludwig K, Yan S, Fan H, Reutter W, Böttcher C: The 3D structure of rat DPPIV/CD26 as obtained by cryo-TEM and single particle analysis. In: Biochem. Biophys. Res. Commun.. 304, Nr. 1, April 2003, S. 73–7. PMID 12705886.
Siehe auch
Einzelnachweise
- E. Prompetchara, C. Ketloy, T. Palaga: Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. In: Asian Pacific journal of allergy and immunology. [elektronische Veröffentlichung vor dem Druck] 02 2020, doi:10.12932/AP-200220-0772, PMID 32105090.
- Hopsu-Havu VK, Glenner GG: A new dipeptide naphthylamidase hydrolyzing glycyl-prolyl-beta-naphthylamide. In: Histochemie. 7, Nr. 3, 1966, S. 197–201. PMID 5959122.
- Alfred Barth, Horst Schulz, Klaus Neubert: Untersuchungen zur Reinigung und Charakterisierung der Dipeptidylaminopeptidase IV. In: Acta biol. med. Germ.. 32, 1974, S. 157-174.
- Jaron: Biopolymers 26, 215, 1987.
- Hartrodt B, Neubert K, Fischer G, Schulz H, Barth A: Synthese und enzymatischer Abbau von β-Casomorphin-5. In: Pharmazie. 37, Nr. 3, März 1982, S. 165–9. PMID 7100234.
- Heymann E, Mentlein R: Liver dipeptidyl aminopeptidase IV hydrolyzes substance P. In: FEBS Lett.. 91, Nr. 2, Juli 1978, S. 360–4. PMID 680144.
- Kreil G, Haiml L, Suchanek G: Stepwise cleavage of the pro part of promelittin by dipeptidylpeptidase IV. Evidence for a new type of precursor--product conversion. In: Eur. J. Biochem.. 111, Nr. 1, Oktober 1980, S. 49–58. PMID 7002560.
- Kato T, Nagatsu T, Fukasawa K, Harada M, Nagatsu I, Sakakibara S: Successive cleavage of N-terminal Arg1--Pro2 and Lys3-Pro4 from substance P but no release of Arg1-Pro2 from bradykinin, by X-Pro dipeptidyl-aminopeptidase. In: Biochim. Biophys. Acta. 525, Nr. 2, August 1978, S. 417–22. PMID 687639.
- Patent DD248961: Process for manufacturing preparations promoting wound healing, and such preparations.. Angemeldet am 22. Mai 1984, veröffentlicht am 26. August 1987, Anmelder: Jentzsch, K. D., Buntrock, P., Oehme, P., Kuhl, A., Neubert, K., Erfinder: Akademie der Wissenschaften der DDR.
- Tansi FL, Blanchard V, Berger M, Tauber R, Reutter W, Fan H: Interaction of human dipeptidyl peptidase IV and human immunodeficiency virus type-1 transcription transactivator in Sf9 cells. (PDF) In: Virol. J.. 7, 2010, S. 267. doi:10.1186/1743-422X-7-267. PMID 20942971. PMC 2967539 (freier Volltext).
- S. Yan, R. Gessner u. a.: Enhanced ovalbumin-induced airway inflammation in CD26−/− mice. In: European Journal of Immunology. Band 42, Nummer 2, Februar 2012, S. 533–540, doi:10.1002/eji.201041038. PMID 22101691.
- Anorge u. a.: IMTM, neuartiges Wirkprinzip, div. Publikationen der Wirkung von bifunktionellen Inhibitoren bei Akne und als Entzündungshemmer.
- H. Cynis, T. Hoffmann u. a.: The isoenzyme of glutaminyl cyclase is an important regulator of monocyte infiltration under inflammatory conditions. In: EMBO molecular medicine. Band 3, Nummer 9, September 2011, S. 545–558, doi:10.1002/emmm.201100158. PMID 21774078. PMC 3377097 (freier Volltext).