Tetraethylorthosilicat
Tetraethylorthosilicat, auch Tetraethoxysilan, Kieselsäuretetraethylester oder Ethylsilicat, kurz TEOS genannt, ist ein Ethylester der Orthokieselsäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
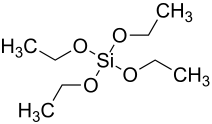 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetraethylorthosilicat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C8H20O4Si | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 208,32 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,94 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
168 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | |||||||||||||||
| Brechungsindex |
1,3928 (20 °C)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
TEOS wird großtechnisch durch Alkoholyse von Siliciumtetrachlorid mit Ethanol hergestellt.[9]
Eigenschaften
Tetraethoxysilan ist eine farblose Flüssigkeit, die unter Normaldruck bei 168 °C siedet.[3] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,17312, B = 1561,277 und C = −67,572 im Temperaturbereich von 289 bis 441,7 K.[10] Die Verdampfungsenthalpie beträgt 49,5 kJ·mol−1[10] Als Feststoff kann die Verbindung in zwei polymorphen Kristallformen vorliegen.[4] Unterhalb von −85,45 °C liegt die Kristallform II vor. Diese wandelt sich bei dieser Temperatur in einer Festphasenumwandlung mit einer Umwandlungenthalpie von 13,2 kJ·mol−1 in die Kristallform I um[4], die dann bei −82,15 °C mit einer Schmelzenthalpie von 11,14 kJ·mol−1 schmilzt.[4]
Tetraethoxysilan bildet oberhalb des Flammpunktes entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 37 °C. Der Explosionsbereich liegt zwischen 0,77 Vol.‑% (67 g/m³) als untere Explosionsgrenze (UEG) und 23 Vol.‑% als obere Explosionsgrenze (OEG).[11][2] Die Zündtemperatur beträgt 230 °C.[11][2] Der Stoff fällt somit in die Temperaturklasse T3.[2]
Verwendung
Es wird in Sol-Gel-Prozessen als Siliciumdioxid-Prekursor zur Herstellung von kolloidalen Sol-Gel-Systemen benutzt. In Wasser ist die Verbindung weitgehend unlöslich. Als Reaktionsmedium wird daher meist ein Gemisch aus Ethanol und Wasser verwendet. Im Neutralen hydrolysiert TEOS in Wasser sehr langsam (mehrere Stunden) zu Orthokieselsäure und Ethanol:
wobei die gebildete Orthokieselsäure durch Ausbildung von Si–O–Si-Bindungen und Abgabe von Wasser weiter in Siliciumdioxid zerfällt:
Erheblich schneller erfolgt die Hydrolyse im Sauren oder Alkalischen, da beides die Reaktion erheblich katalysiert. Im Ammoniakalischen können aus einer TEOS/Ethanol-Mischung, die etwas Wasser enthält, monodisperse Siliciumdioxid-Partikel erhalten werden. In der sogenannten Stöber-Synthese[12] kann durch die Wahl der Konzentrationen, Temperaturen und Ammoniakmenge die Partikelgröße im Bereich von ca. 20–500 nm eingestellt werden. Das Verfahren wird beispielsweise zur Herstellung von photonischen Kristallen[13][14] und künstlichen Opalen[15] verwendet.
In der Zahntechnik findet Tetraethylorthosilikat Verwendung beim Abbindeprozess silikatgebundener Einbettmassen.
Literatur
- K. Nozawa, et al.: Smart control of monodisperse Stöber silica particles: effect of reactant addition rate on growth process. In: Langmuir. Nr. 21, 2005, S. 1516–1523, doi:10.1021/la048569r.
- T. Suratwala, M. L. Hanna, P. Whitman: Effect of humidity during the coating of Stöber silica sols. In: Journal of Non-Crystalline Solids. Nr. 349, 2004, S. 368–376, doi:10.1016/j.jnoncrysol.2004.08.214.
Einzelnachweise
- Eintrag zu TETRAETHYL ORTHOSILICATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Januar 2022.
- Eintrag zu Tetraethylorthosilikat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Datenblatt Tetraethylorthosilicat (PDF) bei Merck, abgerufen am 14. März 2010.
- M.G.M. Van der Vis, E.H.P. Cordfunke, R.J.M. Konings, G.J.K. Van Den Berg,J.C. Van Miltenburg: Tetraethoxysilane, Si(OC2H5)4: heat capacity and thermodynamic properties at temperatures from 0 to 440 K. In: J. Chem. Thermodyn. Bd. 24, 1992, S. 1103–1108, doi:10.1016/S0021-9614(05)80022-9.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-254.
- Eintrag zu Tetraethyl orthosilicate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 78-10-4 bzw. Tetraethylorthosilicat), abgerufen am 2. November 2015.
- Eintrag zu Tetraethyl silicate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 702.
- D.R. Stull: Vapor Pressure of Pure Substances Organic Compounds. In: Ind. Eng. Chem. Bd. 39, 1947, S. 517–540, doi:10.1021/ie50448a022.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- Werner Stöber, Arthur Fink, Ernst Bohn: Controlled growth of monodisperse silica spheres in the micron size range. In: J. Colloid Interface Sci. Bd. 26, 1968, S. 62–69, doi:10.1016/0021-9797(68)90272-5.
- Jian Li, Weihuan Huang, Zhe Wang, Yanchun Han: A reversibly tunable colloidal photonic crystal via the infiltrated solvent liquid–solid phase transition. In: Colloids and Surfaces A: Physicochemical and Engineering Aspects. Bd. 293, 2007, S. 130–134, doi:10.1016/j.colsurfa.2006.07.017.
- Martyn E. Pemble, Maria Bardosova, Ian M. Povey, Richard H. Tredgold, Debra Whitehead: Novel photonic crystal thin films using the Langmuir–Blodgett approach. In: Physica B: Condensed Matter. Bd. 394, 2007, S. 233–237, doi:10.1016/j.physb.2006.12.017.
- L. Pallavidino, et al.: Synthesis, characterization and modelling of silicon based opals. In: Journal of Non-Crystalline Solids. Bd. 352, 2006, S. 1425–1429; doi:10.1016/j.jnoncrysol.2005.10.047.

