Wasserglas
Als Wasserglas werden aus einer Schmelze erstarrte glasartige, also amorphe, wasserlösliche Natrium-, Kalium- und Lithiumsilicate oder ihre wässrigen Lösungen bezeichnet. Je nachdem, ob überwiegend Natrium-, Kalium- oder Lithiumsilicate enthalten sind, spricht man von Natronwasserglas, Kaliwasserglas oder Lithiumwasserglas.

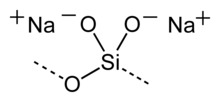
Die Trocknung einer wässrigen Lösung von Wasserglas beginnt mit der Verdunstung von Wasser und wird gefolgt von der Ausbildung wasserunlöslicher Kieselsäure (Verkieselung). Die Verkieselung von Wasserglas ist irreversibel, das heißt durch Zugabe von Wasser zur Kieselsäure entsteht nicht wieder Wasserglas.[1]
Geschichte
Nachdem von Helmond schon 1640 die leichter lösliche Kieselfeuchte[2] entdeckte, wurde das Wasserglas erstmals 1818 durch den Chemiker und Mineralogen Johann Nepomuk von Fuchs hergestellt;[3] Fuchs gab der neuen Verbindung auch ihren Namen.[4] Zusammen mit Franz Xaver Pettenkofer entwickelte er beim Wiederaufbau des 1823 abgebrannten Königlichen Hof- und Nationaltheaters ein Verfahren, mit dem die Entflammbarkeit von Holz herabgesetzt werden sollte. Dabei kamen sie auf die Idee, Dekorationen und Gerüste mit Wasserglas zu überziehen. Später behandelten sie auch bemalte Kulissen mit dem feuerhemmenden Mittel, stellten dabei aber fest, dass dadurch Farbschäden auftraten. Deshalb gingen sie daran, Wasserglas mit anorganischen Farbpigmenten zu mischen. Das neue Malverfahren erhielt später den Namen Stereochromie.[5] „Die ersten größeren Gemälde mit Wasserglasfarben schuf der Kirchen- und Historienmaler Josef Schlotthauer (1789–1869)“.[6]
Herstellung
Zur Herstellung fester Wassergläser (Festgläser) werden Gemenge aus Quarzsand und Kaliumcarbonat (für Kaliwasserglas) bzw. Natriumcarbonat (für Natronwasserglas) unter CO2-Entwicklung bei 1100 °C bis 1200 °C[7] verschmolzen:
- ... (M = Alkalimetall)
Die von der Zusammensetzung der Gemenge abhängige, allgemeine Formel M2O · n SiO2 technisch wichtiger Wassergläser liegt etwa im Bereich zwischen n gleich 1 bis 4.[8] In der Regel werden für ein Wasserglas das Mol- oder Massenverhältnis von SiO2 zu Na2O bzw. SiO2 zu K2O angegeben. Natronwasserglas (siehe auch Natriumsilicate) mit dem Molverhältnis 3,4 bis 3,5 bildet den mengenmäßig wichtigsten Anteil. Die Dichte wird noch häufig in der veralteten Einheit Grad Baumé angegeben.
Das abgekühlte Glas wird zu einem Pulver gemahlen. Daraus wird durch Lösen in Wasser bei hohen Temperaturen (z. B. 150 °C bei 5 bar Druck) flüssiges Wasserglas (Flüssigglas) als klare, kolloide alkalische Lösung oder auch als alkalisches Gel (gallertartige bis feste Masse) gewonnen.
Verwendung
Zur Anwendung kommt meist flüssiges Wasserglas (flüssiges Kalium-/Natriumsilicat, liquid glass, liquor silicium). Natronwasserglas ist nicht für einen dauerhaften Feuchtigkeitsschutz geeignet, weil es sich im Gegensatz zu Kaliwasserglas nach längerer Zeit allmählich auflöst. In der Keramik dient Wasserglas als Elektrolyt zur Verflüssigung einer keramischen Masse. Benutzt wird es zudem als Klebstoff (z. B. zum Aufkleben der Elfenbeinplatten auf Klaviertasten), als Stabilisator von Bleichflotten in der Textil- und Papierindustrie, als Bindemittel (z. B. bei Mineralfarben), als Zusatz in Schweißelektroden, in Waschmitteln, um Bauteile von Waschmaschinen vor Korrosion zu schützen, als Abdichtung bei Mauerwerk, Deponien und im Untertagebau, zum Schutz von Natursteinen vor Witterungseinflüssen, bei Sol-Gel-Prozessen und als Pflanzenstärkungsmittel in der ökologischen Landwirtschaft. In der Mikrobiologie wird Wasserglas als Ersatz für Agar, der im sauren pH-Bereich hydrolysiert, bei der Herstellung von festen Nährmedien für die Anzucht säureliebender (acidophiler) Bakterien eingesetzt. In der Gießereitechnik benutzt man Wasserglas zum Härten von Sandformen und Kernen.
Im Bauwesen findet Wasserglas traditionell Verwendung
- zur Verfestigung und Abdichtung von Putz und Mauerwerk sowie zum Schutz von Natursteinen vor Witterungseinflüssen durch Verkieselung. Je nach Saugfähigkeit des Untergrunds wird es beispielsweise mit zwei Teilen Wasser verdünnt und in einer Menge von ca. 120 bis 380 ml pro Quadratmeter aufgetragen.
- zum Verschließen der Poren der oberflächennahen Schichten von Estrich und Beton[9] Dabei kann die Verschleißfestigkeit um bis zu 15 % erhöht werden[10], die Staubbildung verringert sich und die kapillare Wasseraufnahme nimmt um rund 80 % ab. Lithium-Wasserglas ist deutlich teurer als Natrium- oder Kaliumwasserglas, hat jedoch folgende Vorteile: Seine Wasserlöslichkeit und Alkalinität sind geringer. Dadurch verringert sich die Wahrscheinlichkeit, dass sich Kieselsäure aus dem Zementleim herauslöst und eine Expansion durch die Bildung von Alkalisilikat oder Calciumsilikathydratgel hervorgerufen wird, welche zur Auflockerung der Oberfläche und Bildung von Rissen führt. Die Viskosität ist geringer, wodurch sich die Eindringtiefe erhöht. Die Silikatstrukturen sind größer und vernetzen sich vollständiger, was die Abdichtung der Betonoberfläche verbessert.[11] Die Reaktion mit Kalkhydrat erfolgt langsamer, wodurch sich das Lithiumwasserglas gleichmäßiger in den Poren verteilen kann.
- als Zusatz für Kalkfarben, um deren Haftung sowie Wisch- und Wasserfestigkeit auf silikathaltigen Untergründen zu verbessern
- zur Herstellung einer Antischimmelfarbe, der noch eine fünfprozentige Borax-Lösung hinzugefügt wird
- als Holzschutzmittel und Verringerung der Entzündlichkeit von Bauholz; ein Überstreichen ist im Allgemeinen nach einer Trocknungszeit von zwei bis fünf Tagen möglich
- zum Kleben von Fliesen an Wände und Kachelöfen; eine Haftfestigkeit kann bereits nach 10 Minuten eintreten
In der Konservierung und Restaurierung von Wandmalereien, Steinskulpturen und -objekten wurde Wasserglas als Festigungsmittel verwendet. Aufgrund seiner oftmals geringen Eindringtiefe und der möglichen Bildung von Salzen (Alkalicarbonate in Verbindung mit Kohlendioxid aus der Luft) wird es nicht mehr zur Festigung von Stein verwendet. Kaliumsilikat wird jedoch weiter als Bindemittel für stark farbige, wasserfeste Farben und Beschichtungen (Mineralfarben) von silikathaltigen Untergründen benutzt.[1]
In der Gießereitechnik kann Wasserglas als Bindemittel für Sandformen verwendet werden. Dabei wird das Aushärten meist durch künstliche Begasung mit Kohlendioxid beschleunigt.
In der Zahntechnik findet Wasserglas als Bindemittel Anwendung bei der Herstellung von Feineinbettmassen zum Gießen von Modellgussprothesen.
Im Haushalt kann Wasserglas zum Abdichten von Vasen und Töpferwaren und als Kleber für Papier auf Metall und Glas verwendet werden.
Eine vor der Verbreitung von Kühlschränken gebräuchliche Konservierungsmethode, z. B. zum Einlegen von Eiern, beruht ebenfalls auf Wasserglas: Man rührt eine gewisse Menge der Alkalisilicatlösung in Wasser (meist 1 Teil Wasserglas auf 9 Teile Wasser) und schlägt die Mischung mit einem Schneebesen auf. Nach einer Weile wird die Lösung dann gallertartig/halbfest. In diese Lösung werden die gereinigten Eier eingelegt. Die Wirkung dieser Konservierungsmethode basiert darauf, dass die Poren der Eierschale aufgefüllt werden, so dass das Ei vor dem Eindringen von Wasser, Luft und Mikroorganismen geschützt ist.
Wasserglas (vor allem als Natriumsilicat) kann verwendet werden, um „magische Kristallgärten“ zu erzeugen. Dazu wird Wasserglas mit verschiedenen Metallsalzkristallen vermischt. In der Folge wachsen farbige, stängelartige Gebilde aus den Kristallen heraus. Chemisch gesehen ist dies eine Folge der Polymerisation der Natriumsilicationen unter Einfluss der als Lewissäuren dienenden Metallionen; die Farbe der Gebilde entsteht durch die Substitution der Natriumionen durch andere Metallionen. Die farbigen Fortsätze können sowohl stalaktit- als auch stalagmitähnlich sein, abhängig davon, ob die Kristalle nach unten sinken, oder auf der Oberfläche schweben. Dazu ist zu bemerken, dass die Gebilde nur ihrer Form nach grob an die angegebenen Tropfsteinformationen erinnern und dass die Verteilung (oben/unten) vertauscht ist. Das Wachstum dieser Strukturen nach oben entsteht dadurch, dass das Polymer wie eine semipermeable Membran wirkt, die die hochkonzentrierte Metallsalzlösung einschließt; das Wachstum entsteht dementsprechend durch ein kontinuierliches Aufreißen dieser Membran an der Stelle, wo sie am dünnsten ist (oben).
In den USA wird die Chemikalie benutzt, um zu verschrottende Verbrennungsmotoren vor Inanspruchnahme einer staatlichen Verschrottungsprämie tatsächlich nachweislich unbrauchbar zu machen (Verschrottungspflicht). Dies geschieht, indem das Motoröl durch eine wässrige Natriumsilicatlösung ersetzt wird.[12]
Wasserglas ist ein Bestandteil der sogenannten Einrauchpaste, mit der die Kopfbohrung vieler Tabakspfeifen aus Bruyère ausgekleidet wird, um das Holz beim ersten Rauchen zu schützen.
Im April 2011 wurde ein Abdichtmittel auf Wasserglas-Basis zum Verschließen eines Lecks am havarierten japanischen Kernkraftwerk Fukushima I verwendet, aus dem hoch kontaminiertes Wasser ins Meer austrat.[13][14]
Weblinks
- Wasserglas. Eintrag in Meyers Großem Konversations-Lexikon, 6. Auflage, 1905–1909, online verfügbar bei Zeno.org
- Sicherheitsdatenblatt Kali-Wasserglas (PDF; 323 kB)
- Sicherheitsdatenblatt Natronwasserglas (PDF)
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Disodium silicate, pentahydrate
Einzelnachweise
- Wasserglas. In: Angela Weyer et al. (Hrsg.): EwaGlos. European Illustrated Glossary Of Conservation Terms For Wall Paintings And Architectural Surfaces. English Definitions with translations into Bulgarian, Croatian, French, German, Hungarian, Italian, Polish, Romanian, Spanish and Turkish. Michael Imhof, Petersberg 2015, ISBN 978-3-7319-0260-7, S. 402, doi:10.5165/hawk-hhg/233 (Download).
- Zeno.org: Kieselfeuchtigkeit
- Fraunhofer IRB: Chemie und Eigenschaften von Wasserglas (Memento vom 4. Januar 2012 im Internet Archive)
- Eintrag zu Wasserglas. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. April 2011.
- Walter Ackermann: Johann Nepomuk Fuchs (1774-1856). Mineraloge und Chemiker. Die Oberpfalz, 2018, 106. Jahrgang, S. 92–96.
- Salzgitter aktuell: Wasserglas:Bindemittel für Mörtel und Beton (Memento vom 26. April 2014 im Internet Archive)
- Soluble Silicate Manufacture (Englisch) (Memento vom 14. Oktober 2008 im Internet Archive) (PDF; 26 kB)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 779.
- S. A. Wyrzgol: Was man über Wasserglas wissen sollte (Memento vom 17. Juli 2013 im Internet Archive) (PDF; 176 kB), Obtego AG, Neufahrn
- B.‐Y. Youn, Schlussbericht Beurteilung der Wirksamkeit von Wasserglas zur Verbesserung des Verschleißwiderstandes bei Industrieböden, Lehrstuhl für Baustofftechnik, Ruhr-Universität Bochum, Fraunhofer IRB Verlag, 2010.
- F. Gaboriaud et al., J. Phys. Chem. B 1999, 103, 2091–2099
- DerStandard: Killer-Chemie belebt neuen Markt, 11. August 2009.
- Wasserglas dichtet Leck in Fukushima ab. Meldung beim Deutschlandfunk vom 6. April 2011.
- Out flow of fluid containing radioactive materials to the ocean from areas near intake channel of Fukushima Daiichi Nuclear Power Station Unit 2 (continued report) (Memento vom 24. April 2011 auf WebCite) (englisch, pdf). Tepco, 6. April 2011, archiviert vom Original, abgerufen am 17. Mai 2011.