Nickel(II)-bromid
Nickel(II)-bromid, NiBr2, ist das Nickel-Salz der Bromwasserstoffsäure. Es bildet gelbbraune, rhomboedrische, hygroskopische, in Wasser und Ethanol gut lösliche Kristalle, die bei 965 °C sublimieren.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
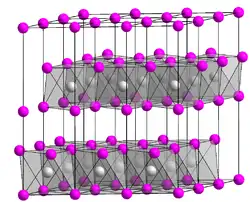 | |||||||||||||||||||
| _ Ni2+ _ Br− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Nickel(II)-bromid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | NiBr2 | ||||||||||||||||||
| Kurzbeschreibung |
gelb-orangefarbener Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 218,501 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
5,09 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Das wasserfreie Nickel(II)-bromid ist ein gelbes bis bronzegelbes stark hygroskopisches Salz. Bei Wasserzutritt geht es in das Trihydrat NiBr2 · 3 H2O über. Es existiert auch ein grünes Hexahydrat, das bei 28,5 °C in das Trihydrat übergeht.[3] Das gelbgrüne Trihydrat geht bei 200 °C in das Anhydrat über.[6] Es wird auch die Existenz eines hellgrünen Nona- (Schmelzpunkt −2,5 °C) und eines Octahydrates angenommen.[7]

Sublimierte Produkte von wasserfreiem Nickel(II)-bromid besitzen eine Kristallstruktur vom Cadmiumchlorid Typ mit der Raumgruppe R3m (Raumgruppen-Nr. 160) (a=3,708, c=18,300 Å), nichtsublimierte Produkte besitzen eine Wechselstruktur des Cadmiumhydroxid- und Cadmiumchlorid-Typs.[3]
Im gasförmigem Zustand liegt Nickel(II)-bromid als monomeres Molekül vor. Bei starker Erhitzung an Luft geht es in Nickel(II)-oxid und Brom über.[7]
Darstellung und Gewinnung
Nickel(II)-bromid lässt sich durch Einwirkung von Brom auf erhitztes Nickel darstellen.[3]
Ebenfalls möglich ist die Darstellung durch Erhitzen von Nickel(II)-chlorid im Bromwasserstoff-Strom auf 500 °C, durch Erhitzen des Hexahydrates auf 140 °C im Trockenschrank oder durch Umsetzen von Nickel(II)-acetat mit Acetylbromid in Benzol gewonnen werden.[3]
Das Hexahydrat kann dargestellt werden, indem das Anhydrat in Wasser aufgelöst wird, bis zur Kristallisation eingedampft, dann abgekühlt und aus Alkohol umkristallisiert werden. Ebenfalls möglich ist es, dieses aus gefälltem Nickel(II)-carbonat, Nickel(II)-oxid[6] oder Nickel(II)-hydroxid durch Auflösung in wässrigem Bromwasserstoff, anschließendem Eindampfen und aus Alkohol umkristallisieren zu gewinnen.[3]
Durch Dehydration des Hexahydrates über konzentrierter Schwefelsäure bei 5 °C kann das Dihydrat hergestellt werden.[8]
Verwendung
Nickel(II)-bromid kann zur Herstellung von Nickelverbindungen (z. B. Bis(triphenylphosphin)-nickel(II)-bromid oder Komplexverbindungen wie Hexaamminnickel(II)-bromid) verwendet werden.
Weblinks
- Die Kristallstruktur des Nickelbromids und -jodids. (PDF; 487 kB)
- Kazumi Yamamoto: Zur Kenntnis über die Hochdrucksynthese von Acrylester. I. Erkenntnisse bei der Acrylestersynthese unter der Anwendung von Nickelhalogenid-Katalysator. In: Bulletin of the Chemical Society of Japan. Band 27, Nr. 8, 1954, S. 491–495, doi:10.1246/bcsj.27.491.
- University of British Columbia: Nickel bromide as a hydrogen transfer catalyst. (PDF).
Einzelnachweise
- Datenblatt Nickel(II)-bromid (PDF) bei Merck, abgerufen am 24. Dezember 2010.
- webelements.com: Nickel(II)-bromid
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1688.
- Eintrag zu Nickel dibromide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Nickel(II)-bromid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 978-1-4398-1462-8, S. 289 (eingeschränkte Vorschau in der Google-Buchsuche).
- R. J. Meyer: Nickel Teil B – Lieferung 2. Verbindungen bis Nickel-Polonium. Springer-Verlag, 2013, ISBN 978-3-662-13302-6, S. 601–612 (eingeschränkte Vorschau in der Google-Buchsuche).
- D. Nicholls: The Chemistry of Iron, Cobalt and Nickel Comprehensive Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-4643-0, S. 1127 (eingeschränkte Vorschau in der Google-Buchsuche).

