Nickel(II)-iodid
Nickel(II)-iodid ist eine chemische Verbindung der Elemente Nickel und Iod. Der Reinstoff ist ein schwarzer, kristalliner Feststoff, der bei 797 °C schmilzt.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
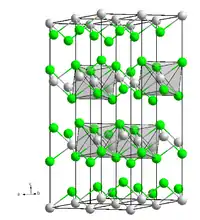 | ||||||||||||||||
| _ Ni2+ _ I− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nickel(II)-iodid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | NiI2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 312,502 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
5,83 g·cm−3[4] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Nickel(II)-iodid kann direkt aus den Elementen gewonnen werden:[7]
Eine weitere Möglichkeit der Darstellung ist die Iodierung von Nickel(II)-chlorid mit Natriumiodid:[8]
Ebenfalls möglich ist die Darstellung durch Reaktion von Nickel(II)-hydroxid oder Nickel(II)-carbonat mit Iodwasserstoffsäure.[9]
Eigenschaften
Nickel(II)-iodid kristallisiert im trigonalen Kristallsystem mit der Raumgruppe R3m (Raumgruppen-Nr. 166) und den Gitterparametern a = 392,9 pm und c = 1981,1 pm, in der Elementarzelle befinden sich drei Formeleinheiten. Die Struktur entspricht damit der CdCl2-Struktur.[10]
Nickel(II)-iodid löst sich, wie auch die anderen Nickelhalogenide außer Nickel(II)-fluorid, in Wasser zum blaugrünen Hexahydrat:[8]
Dessen Kristalle zerfließen an Luft schnell und färben sich braun unter Iodabscheidung. Ab 43 °C zersetzt sich die Verbindung. Beim Erhitzen auf einem Wasserbad wandelt es sich in die wasserfreie Form um.[9]
Einzelnachweise
- webelements.com: Nickeldiiodide, aufgerufen am 18. Januar 2012.
- W. Segerblom: Tables of Properties of Over Fifteen Hundred Common Inorganic Substances. Verlag Read Books, 2010, ISBN 978-1-4455-9102-5, S. 47 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Nickel (II) iodide hydrate (PDF) bei Strem, abgerufen am 25. Dezember 2012.
- Datenblatt Nickel(II)-iodid bei Sigma-Aldrich, abgerufen am 27. Dezember 2010 (PDF).
- Eintrag zu Nickel diiodide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Nickeldiiodid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage. Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1476.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1713.
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1688.
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage. Springer, 1997, ISBN 3-540-60035-3, S. 496 (eingeschränkte Vorschau in der Google-Buchsuche).
Weblinks
- Kristallstrukturen von Nickel(II)-bromid und -iodid (PDF; 499 kB)

