Cadmiumhydroxid
Cadmiumhydroxid ist eine chemische Verbindung des Cadmiums aus der Gruppe der Hydroxide. Es ist ein fester, weißer Stoff, der sich bei ungefähr 300 °C zersetzt.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
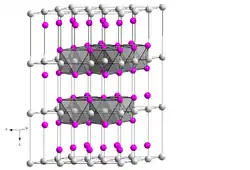 | |||||||||||||||||||
| _ Cd2+ _ OH− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cadmiumhydroxid | ||||||||||||||||||
| Andere Namen |
Cadmiumdihydroxid | ||||||||||||||||||
| Verhältnisformel | Cd(OH)2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 146,43 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, erbgutverändernd (CMR), ernsthafte Auswirkungen auf die menschliche Gesundheit gelten als wahrscheinlich[4] | ||||||||||||||||||
| MAK |
aufgehoben, da karzinogen[1] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Cadmiumhydroxid entsteht durch Reaktion von Basen mit Cadmiumsalzlösungen und Ausfällung. Feinkristallines Cadmiumhydroxid kann nur durch Reaktion von Cadmiumnitratlösungen mit Natriumhydroxid erhalten werden.[5]
Hohe Konzentrationen an Halogenid-Ionen verhindern die Bildung von Cadmiumhydroxid, da sich das [CdX4]2−-Ion (X= F, Cl, Br, I) bildet.[5]
Eigenschaften
Cadmiumhydroxid kristallisiert im trigonalen Kristallsystem mit der Raumgruppe P3m1 (Raumgruppen-Nr. 164) mit den Gitterparametern a = 349,9 pm und c = 470,1 pm sowie einer Formeleinheit pro Elementarzelle. Die Struktur entspricht damit der Brucit-Struktur und dem Polytyp 2H der Cadmiumiodidstruktur.[6]
Cadmiumhydroxid ist im Vergleich zu Zinkhydroxid stärker basisch und löst sich daher nur in starken Basen. In Ammoniak ist es unter Bildung von Hexaammin-Ionen [Cd(NH3)6]2+ löslich.[7]
Verwendung
Cadmiumhydroxid dient als Anodenmaterial entladener Nickel-Cadmium-Akkumulatoren. In der Anodenfertigung wird es durch Oxidation von metallischem Cadmium durch Wasserstoffperoxid auf dem Trägermaterial erzeugt. Auch entsteht es während des Entladungsvorganges dieser Akkumulatoren, beim Laden wird es zu Cadmium reduziert.[8]
Für die Gewinnung anderer Cadmiumverbindungen ersetzt es häufiger Cadmiumoxid.[5]
Sicherheitshinweise
Auf Vorschlag der schwedischen Chemikalienbehörde wurde 2015 die chemikalienrechtliche Einstufung von Cadmiumhydroxid überarbeitet. Der Ausschuss für Risikobewertung (RAC) der Europäischen Chemikalienagentur (ECHA) hat am 4. Dezember die Einstufung für Cadmiumhydroxid wie folgt geändert: Cadmiumhydroxid wird als krebserzeugend Carc 1B, mutagen Muta 1B und STOT RE 1 eingestuft, die zusätzlichen Warnhinweise wurden festgelegt auf H340, H350 und H372 (Niere, Knochen).[9] Diese Einstufung des RAC muss noch von der EU-Kommission in geltendes Recht umgesetzt werden aber sie stellt mit der Veröffentlichung den Stand des Wissens dar, der von Unternehmen und Behörden berücksichtigt werden muss.
Einzelnachweise
- Datenblatt Cadmiumhydroxid bei AlfaAesar, abgerufen am 1. September 2010 (PDF) (JavaScript erforderlich).
- Eintrag zu Cadmium hydroxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 22. November 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Cadmiumhydroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 19. Januar 2018.
- Karl-Heinz Schulte-Schrepping, Magnus Piscator: Cadmium and Cadmium compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2002, doi:10.1002/14356007.a04_499.
- Jean D'Ans, Ellen Lax: Taschenbuch Fur Chemiker und Physiker: Band 3: Elemente, Anorganische Verbindungen und Materialien, Minerale. 3. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 1374 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gerd Blumenthal, Dietmar Linke, Siegfried Vieth: Chemie: Grundwissen für Ingenieure. Vieweg+Teubner Verlag, 2006, ISBN 978-3-5190-3551-0, S. 356 (eingeschränkte Vorschau in der Google-Buchsuche).
- Karl-Heinz Lautenschläger, Werner Schröter: Taschenbuch der Chemie. 20. Auflage, Harri Deutsch Verlag, 2007, ISBN 978-3-8171-1761-1, S. 379 (eingeschränkte Vorschau in der Google-Buchsuche).
- RAC-Entscheidung vom 4. Dezember 2015


